
【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质的溶液,pH由大到小的顺序是___________(填编号)。
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是_______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图。则HX的电离常数___________(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中水电离出来的c(H+)_________(填“大于”、“等于”或“小于”)醋酸溶液水电离出来的c(H+)。

(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=_______________________(填准确数值)。
(5)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时c mol/L的HX的电离度为a,试表示该温度下HX的电离平衡常数K=_____________________。(用含“ c、a的代数式表示”)
【答案】a>b>d>c A 大于 大于 9.9×10-7 mol/L ca2/(1-a)
【解析】
(1)根据“越弱越水解”分析;(2)CH3COOH溶液加水稀释过程中,醋酸的电离程度增大,氢离子物质的量增大,氢离子浓度、醋酸根离子浓度减小,但氢氧根离子浓度增大;(3)稀释相同倍数,pH变化越大酸性越强;酸电离出的氢离子浓度越大,水电离出来的c(H+)越小;(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,c(H+)=10-6mol/L、c(OH-)= 10-8mol/L,根据电荷守恒计算c(CH3COO-)-c(Na+);(5)HX的电离平衡常数K=c(H+)c(X-)/c(HX)。
(1)电离平衡常数:CH3COOH> H2CO3> HClO > HCO3-,所以水解程度:CH3COO-<HCO3-< ClO- < CO32-,物质的量浓度为0.1 mol/L 的Na2CO3、NaClO、CH3COONa、NaHCO3,pH由大到小的顺序是Na2CO3 >NaClO>NaHCO3>CH3COONa ,即a>b>d>c;(2)CH3COOH溶液加水稀释过程中,醋酸的电离程度增大,氢离子物质的量增大,氢离子浓度、醋酸根离子浓度减小,但氢氧根离子浓度增大;![]() ,醋酸根离子浓度减小,所以c(H+)/c(CH3COOH)增大;KW=c(H+)·c(OH-),温度不变,c(H+)·c(OH-)不变;氢氧根离子浓度增大,氢离子浓度减小,所以 c(OH-)/c(H+)增大,故选A;(3)稀释相同倍数,pH变化越大酸性越强,稀释相同倍数,HX的pH 变化大于CH3COOH,所以HX的电离常数大于醋酸的电离常数;稀释后,HX电离出的氢离子浓度小于醋酸电离出的氢离子,所以HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+);(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,c(H+)=10-6mol/L、c(OH-)= 10-8mol/L,根据电荷守恒c(CH3COO-)-c(Na+)= c(H+) - c(OH-)= 10-6mol/L-10-8mol/L=9.9×10-7 mol/L;(5)HX的电离平衡常数K= c(H+)c(X-)/c(HX)=
,醋酸根离子浓度减小,所以c(H+)/c(CH3COOH)增大;KW=c(H+)·c(OH-),温度不变,c(H+)·c(OH-)不变;氢氧根离子浓度增大,氢离子浓度减小,所以 c(OH-)/c(H+)增大,故选A;(3)稀释相同倍数,pH变化越大酸性越强,稀释相同倍数,HX的pH 变化大于CH3COOH,所以HX的电离常数大于醋酸的电离常数;稀释后,HX电离出的氢离子浓度小于醋酸电离出的氢离子,所以HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+);(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,c(H+)=10-6mol/L、c(OH-)= 10-8mol/L,根据电荷守恒c(CH3COO-)-c(Na+)= c(H+) - c(OH-)= 10-6mol/L-10-8mol/L=9.9×10-7 mol/L;(5)HX的电离平衡常数K= c(H+)c(X-)/c(HX)=![]() ca2/(1-a)。
ca2/(1-a)。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列对氧化还原反应的分析中合理的是( )
A. Mg变成MgO时化合价升高,失去电子,因此Mg在该反应中被还原了
B. KMnO4受热分解,Mn元素化合价一方面升高,一方面降低,因此Mn元素既被氧化又被还原
C. CuSO4+2NaOH=Cu(OH)2↓+Na2SO4不属于氧化还原反应
D. 反应2H2O![]() 2H2↑+O2↑,H2O中H元素的化合价既有升高,又有降低
2H2↑+O2↑,H2O中H元素的化合价既有升高,又有降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1。一定条件下,向1 L密闭容器中投入0.8 mol的NH3和1.6 mol的O2,发生上述反应,第2 min和第4 min时NH3的物质的量分别为0.6 mol和0.3 mol。下列说法中不正确的是
A. 上述反应的逆反应的活化能不小于905.9 kJ·mol-1
B. 反应在第2 min到第4 min时,O2的平均速率为0.15 mol·L-1·min-1
C. 反应第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
D. 平衡后降低压强,混合气体平均摩尔质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abcB.bcdC.cbdD.abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。下列说法正确的是
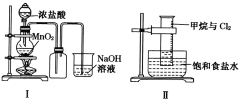
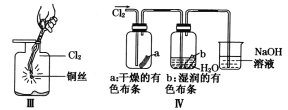
A. I图中:如果MnO2过量,浓盐酸就可全部被消耗
B. II图中:量筒中发生了加成反应
C. III图中:生成蓝色的烟
D. IV图中:湿润的有色布条能褪色将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列制备单质的方法中,需要加入还原剂才能实现的是( )
A.高炉炼铁B.电解法制金属镁
C.加热氧化汞制金属汞D.从海带灰浸取液中(含I-)提取碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应 mA(g)![]() nB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
nB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A. 平衡向逆反应方向移动了 B. 物质A的转化率减少了
C. 物质B的质量分数减小了 D. m 小于n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

(1)反应的ΔH_______0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s,反应速率v(N2O4)为____________mol·L-1·s-1;反应的平衡常数K1为_____________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4) 以0.001 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是________________。 ②温度T时反应的平衡常数K2____________________。
(3)温度T时反应达平衡后,将反应容器的容积扩大一倍。平衡向____________ (填“正反应”或“逆反应”)方向移动,判断理由是_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com