
【题目】下列制备单质的方法中,需要加入还原剂才能实现的是( )
A.高炉炼铁B.电解法制金属镁
C.加热氧化汞制金属汞D.从海带灰浸取液中(含I-)提取碘单质
科目:高中化学 来源: 题型:
【题目】加热N2O5时,发生以下两个分解反应:N2O5![]() N2O3+O2,N2O3
N2O3+O2,N2O3![]() N2O+O2,在1 L密闭容器中加热4 mol N2O5达到化学平衡时c(O2)为4.50 mol/L,c(N2O3)为1.62 mol/L,则在该温度下各物质的平衡浓度正确的是
N2O+O2,在1 L密闭容器中加热4 mol N2O5达到化学平衡时c(O2)为4.50 mol/L,c(N2O3)为1.62 mol/L,则在该温度下各物质的平衡浓度正确的是
A. c(N2O5)=1.44 mol/L B. c(N2O5)=0.94 mol/L
C. c(N2O)=1.40 mol/L D. c(N2O)=3.48 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)9.03×1023个CH4中,含____mol碳原子,___mol氢原子,___mol质子,____mol电子。与___个NH3含有相同数目的氢原子。
(2)与17gNH3所含有分子数相同的氧气的体积(标准状况)是_____L。
(3)某3.65g气体在标准状况下的体积是2.24L,则其摩尔质量是________。
(4)标准状况下9.03×1023个CH4所占的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质的溶液,pH由大到小的顺序是___________(填编号)。
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是_______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图。则HX的电离常数___________(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中水电离出来的c(H+)_________(填“大于”、“等于”或“小于”)醋酸溶液水电离出来的c(H+)。

(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=_______________________(填准确数值)。
(5)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时c mol/L的HX的电离度为a,试表示该温度下HX的电离平衡常数K=_____________________。(用含“ c、a的代数式表示”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 第三周期元素,浓度均为0.01 mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法正确的是
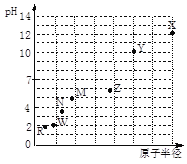
A. 气态氢化物的稳定性:N>R
B. Z的最高价氧化物对应的水化物能溶于稀氨水
C. Y和R形成的化合物既含离子键又含共价键
D. X和M两者最高价氧化物对应的水化物反应后溶液的pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa下,0.1 mol甲醇燃烧生成CO2和液态水时放热72.58 kJ,下列热化学方程式正确的是
A. CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=+725.8 kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1451.6 kJ/mol
C. CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
D. 2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1451.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/ (mol·L-1) | 0.44 | 0.6 | 0.6 |
(1)比较此时正.逆反应速率的大小:v正_______v逆(填“>”“<”或“=”)。
(2)若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=___________;该时间内反应速率v(CH3OH)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“>”“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)===2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2。
(2)相同条件下,2 mol氢原子所具有的能量______1 mol氢分子所具有的能量。
(3)已知常温下红磷比白磷稳定,比较下列反应中(反应条件均为点燃)ΔH的大小:ΔH1______ ΔH2。
①P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1,
②4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2。
(4)已知:101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则碳的燃烧热数值________110.5 kJ·mol-1。
(5)已知:稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量________57.3 kJ;稀硫酸和稀氢氧化钡溶液中和生成1 mol 水放出的热量_______________57.3 kJ。
(6)已知一定条件下合成氨反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。
2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com