
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】将一块金属钠露置于空气中,观察到下列现象:
![]()
请回答下列问题:
(1)白色粉末的化学式是__________,过程②的化学方程式是_________。
(2)下列说法正确的是________。
A. 过程③为物理变化
B. 过程④是碳酸钠吸收空气中的CO2、水蒸气形成了碳酸氢钠
C. 过程⑤发生了分解反应
D. 整个变化过程中只有一个氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100 kPa、298.15 K时氢氟酸的电离过程HF(aq)H+(aq)+F-(aq) ΔH=-12.5kJ·mol-1,ΔS=-102.5 J·mol-1·K-1,试判断该过程的自发性( )
A. 可自发进行 B. 不能自发进行 C. 达到平衡 D. 不能判定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL0.1mol/LNH4Cl溶液中,逐滴滴加0.1mol/L NaOH溶液。NH4+和NH3·H2O的变化趋势如图所示(不考虑NH3的逸出)。下列说法正确的是

A. M点溶液中水的电离程度比原溶液大
B. 在M点时,n(H+)-n(OH-)=(0.005-a)mol
C. 随着NaOH溶液的滴加,![]() 不断增大
不断增大
D. 当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑在工业上应用价值广泛,它的一种提取工艺流程如下,请回答下列问题:
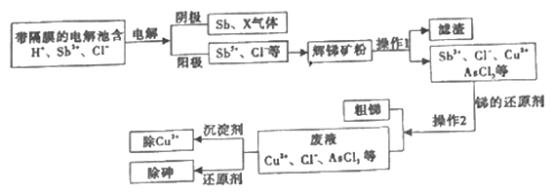
(1)辉锑矿是含锑的重要矿物,其主要成分是Sb2S3其中Sb的化合价是______。
(2)写出阳极区产物与辉锑矿粉主要成分发生反应的化学方程式______。
(3)电解池所用的“隔膜”宜采用______交换膜(填“阳离子”、“阴离子”或“质子”)。为促使Sb3+向阳极迁移加快反应,通常要进行的操作是_________。“电解” 中阴极反应的产物之一X是______。(填化学式)。
(4)为除去操作I所得滤液中的Cu2+,可加入Na2S。若滤液中c(Cu2+)= 0.01mol/L,当溶液中Cu2+恰好完全沉淀时,c(S2-)=______mol/L。 [已知Ksp(CuS)= 8×10-45]
(5)除去废液中的 AsCl3,是用次磷酸钠( NaH2PO2)还原AsCl3,产生了棕色单质砷沉淀和H3PO3。该反应中氧化剂和还原剂的物质的量之比为______,氧化产物是_____________。
(6)若电解池阴极得到1mol X气体,同时电路中转移6mole-,阴极生成的m( Sb)=____ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于取代反应的是
A. ![]() + HO-NO2
+ HO-NO2 ![]()
![]()
B. ClCH2CH=CH2 + NaOH![]() HOCH2CH=CH2 + NaCl
HOCH2CH=CH2 + NaCl
C. 2 CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
D. BrCH2CH3 + NaOH![]() CH2 = CH2 ↑+ NaBr +H2O
CH2 = CH2 ↑+ NaBr +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
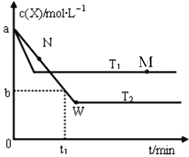
A. M点的 v正小于N点的v逆
B. M点时,升高温度平衡逆向移动
C. T2下,在0-t1时间内,v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
D. W点时再加入一定量Y,平衡后Y的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到目的的是
A. 用乙醇作萃取剂萃取溴水中的溴
B. 用燃烧法除去CO2中混有的少量CO
C. 用焰色反应鉴别Na2SO4溶液和NaCl溶液
D. 用加热法除去Na2CO3固体中的少量NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com