
【题目】锑在工业上应用价值广泛,它的一种提取工艺流程如下,请回答下列问题:
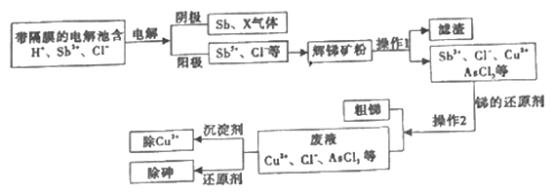
(1)辉锑矿是含锑的重要矿物,其主要成分是Sb2S3其中Sb的化合价是______。
(2)写出阳极区产物与辉锑矿粉主要成分发生反应的化学方程式______。
(3)电解池所用的“隔膜”宜采用______交换膜(填“阳离子”、“阴离子”或“质子”)。为促使Sb3+向阳极迁移加快反应,通常要进行的操作是_________。“电解” 中阴极反应的产物之一X是______。(填化学式)。
(4)为除去操作I所得滤液中的Cu2+,可加入Na2S。若滤液中c(Cu2+)= 0.01mol/L,当溶液中Cu2+恰好完全沉淀时,c(S2-)=______mol/L。 [已知Ksp(CuS)= 8×10-45]
(5)除去废液中的 AsCl3,是用次磷酸钠( NaH2PO2)还原AsCl3,产生了棕色单质砷沉淀和H3PO3。该反应中氧化剂和还原剂的物质的量之比为______,氧化产物是_____________。
(6)若电解池阴极得到1mol X气体,同时电路中转移6mole-,阴极生成的m( Sb)=____ g。
【答案】 +3 Sb2S3+3SbCl5=5SbCl3+3S 阴离子 电解过程中需要不断搅拌 H2 8×10-40 2:3 H3PO3 162.7
【解析】(1)Sb2S3中S的化合价为-2价,根据化合价代数和为0,计算出Sb的化合价是+3。
(2)阳极区产物SbCl3与Sb2S3发生氧化还原反应,得到SbCl3,锑的化合价降低,则硫的化合价一定升高,结合流程图分析,滤液中不含硫元素,氧化产物为硫单质,进入滤渣,所以化学方程式为Sb2S3+3SbCl5=5SbCl3+3S。
(3)阴极发生还原反应生成锑和氢气,Cl-过剩,阳极缺Cl-,故采用阴离子交换膜。为促使Sb3+向阳极迁移加快反应,通常要进行的操作是电解过程中需要不断搅拌。“电解”中阴极发生还原反应,产物之一X是H2。因此本题正确答案为:阴离子;电解过程中需要不断搅拌;H2
(4)根据Ksp(CuS)=c(Cu2+)·c(S2-)=8×10-45,当溶液中Cu2+恰好完全沉淀时,c(Cu2+)≤10-5mol/L,c(S2-)=![]() mol/L=8×10-40 mol/L。
mol/L=8×10-40 mol/L。
(5)AsCl3与NaH2PO2反应生成单质砷沉淀和H3PO3。根据原子守恒,反应物有水参加,化学方程式为:2AsCl3+3NaH2PO2+3H2O=2As↓+3H3PO3+3NaCl+3HCl,该反应中氧化剂为AsCl3,还原剂为NaH2PO2,二者物质的量之比为2:3,氧化产物是H3PO3。
(6)电解池阴极得到1molH2时,转移2mole-,电路中共转移6mole-,则生成Sb时转移4mole-,由Sb3++3e-=Sb知,阴极生成的m(Sb)=![]() mol×121.8g/mol=162.7g。
mol×121.8g/mol=162.7g。


科目:高中化学 来源: 题型:
【题目】晶须是由高纯度单晶生长而成的微纳米级的短纤维,工业应用的晶须主要是在人工控制条件下合成。
碳酸镁晶须(MgCO3·nH2O,n = 1~5的整数)广泛应用于冶金、耐火材料及化工产品等领域。制取碳酸镁晶须的步骤如图:
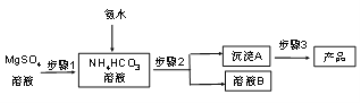
完成下列填空:
(1)步骤1必须将反应的温度控制在50℃,较好的加热方法是_______________________;氨水、硫酸镁、碳酸氢铵三者反应,除生成MgCO3·nH2O沉淀外,同时生成的产物还有______________________________________。
(2)步骤2是__________、洗涤,检验沉淀A已洗涤干净的方法是_____________________。
为测定碳酸镁晶须产品中n的值,某兴趣小组设计了如下装置,并进行了三次实验。(不考虑稀盐酸的挥发性)
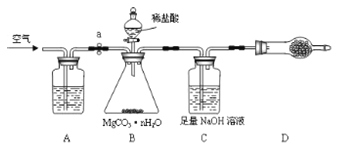
(3)装置A中盛放的溶液是_____________。装置D中盛放的固体是___________________,其作用是_________________________________。
(4)若三次实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,则n值为__________________(用含a的代数式表达)。
(5)下列选项中,会造成实验结果偏大的是____________。 (选填序号)
①实验开始,未先通空气,即称量装置C; ②B中反应结束后,没有继续通空气;
③缺少装置A; ④缺少装置D;
⑤装置B中稀盐酸的滴加速率过快; ⑥装置C中的NaOH溶液浓度过大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为由石油制取汽油的装置示意图,根据图示回答下列问题。

(1)图中的两处明显的错误是________________、__________________
(2)A仪器的名称是________,B仪器的名称是________。
(3)实验时 A 中除加入石油外,还需加入少量__________,其作用是__________________。
(4)收集完汽油后,是先撤酒精灯还是先停冷凝水?
______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的C/Na4Fe(CN)6--钠离子电池是一种新型电池。下列有关说法正确的是
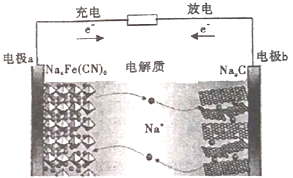
A. 电极a在放电时做正极,充电时做阴极
B. 放电时,电极b上的电极反应为:NaxC-e-=Na++Nax-1C
C. 电池工作时,Na+向电板b移动
D. 该电池通过Na+的定向移动产生电流,不发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用铜萃取剂,使溶液中的Cu2+富集进入有机相,再经过进一步的反萃取实现金属铜的沉积、再生,铜萃取剂富集Cu2+的原理如下:
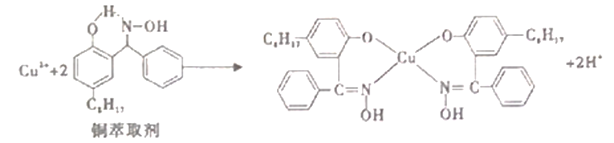
(1)基态铜原子所失去的第一个电子所占据的能层符号是______,价铜离子的简化电子排布式为_________。
(2)铜萃取剂中所含元素的电负性由大到小顺序为______,N原子以_____杂化轨道与O原子形成σ键。
(3)铜萃取剂与Cu2+形成的配合物在水相的溶解度______有机相的溶解度(填“>”、“<”、“=”),该配合物晶体类型为_____ 。
(4)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液![]() 蓝色沉淀
蓝色沉淀![]() 沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式_________;沉淀溶解后溶液中的阳离子内存在的化学健类型有________。
沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式_________;沉淀溶解后溶液中的阳离子内存在的化学健类型有________。
(5)铜的一种氯化物的晶胞如图所示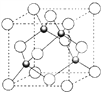 ,该氯化物的化学式_____,Cu和Cl之间最短距离为460.0pm,则晶体密度为______g/cm3。(列式表示)
,该氯化物的化学式_____,Cu和Cl之间最短距离为460.0pm,则晶体密度为______g/cm3。(列式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医药合成中可用下列流程合成一种治疗心脏病的特效药物(G)。

已知:①RCH=CH2![]() RCH2CH2CHO;
RCH2CH2CHO;
②
(1)B的核磁共振氢谱图中有_______组吸收峰,C的名称为_________。
(2)E中含氧官能团的名称为_______,写出D→E的化学方程式_______ 。
(3)E-F的反应类型为________ 。
(4)E的同分异构体中,结构中有醚键且苯环上只有一个取代基结构有_____种,写出其中甲基数目最多的同分异构体的结构简式_______ 。
(5)下列有关产物G的说法正确的是__________
A.G的分子式为C15H28O2 B.1molG水解能消耗2molNaOH
C.G中至少有8个C原子共平面 D.合成路线中生成G的反应为取代反应
(6)写出以1-丁醇为原料制备C的同分异构体正戊酸(CH3CH2CH2CH2COOH)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH,无机试剂任选。___________
CH3CH2OH,无机试剂任选。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是 ( )
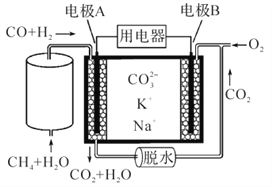
A. 催化重整中CH4+H2O=3H2+CO,1 mol CH4参加反应转移2 mol电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上的电极反应:O2+2CO2+4e- =2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol/ (NH4)2S溶液中NH4+ 的物质的量浓度_____________。
(2)标准状况下,1.7 g NH3与______L H2S气体含有的氢原子数相同。
(3)标准状况下,1.6g某气态氧化物RO2体积为0.56L,该气体的物质的量为____mol,RO2的相对分子质量为_______。
(4)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O该反应中的氧化剂是________,若有4molHCl参加反应,则被氧化的HCl的物质的量是______mol,如反应中转移了0.4mol电子,则产生的Cl2在标准状况下体积为_________L。
MnCl2+Cl2↑+2H2O该反应中的氧化剂是________,若有4molHCl参加反应,则被氧化的HCl的物质的量是______mol,如反应中转移了0.4mol电子,则产生的Cl2在标准状况下体积为_________L。
(5)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为______,该气体对氢气的相对密度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com