
【题目】晶须是由高纯度单晶生长而成的微纳米级的短纤维,工业应用的晶须主要是在人工控制条件下合成。
碳酸镁晶须(MgCO3·nH2O,n = 1~5的整数)广泛应用于冶金、耐火材料及化工产品等领域。制取碳酸镁晶须的步骤如图:
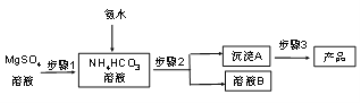
完成下列填空:
(1)步骤1必须将反应的温度控制在50℃,较好的加热方法是_______________________;氨水、硫酸镁、碳酸氢铵三者反应,除生成MgCO3·nH2O沉淀外,同时生成的产物还有______________________________________。
(2)步骤2是__________、洗涤,检验沉淀A已洗涤干净的方法是_____________________。
为测定碳酸镁晶须产品中n的值,某兴趣小组设计了如下装置,并进行了三次实验。(不考虑稀盐酸的挥发性)
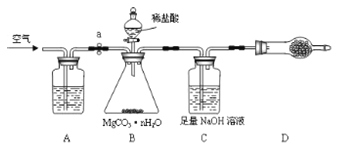
(3)装置A中盛放的溶液是_____________。装置D中盛放的固体是___________________,其作用是_________________________________。
(4)若三次实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,则n值为__________________(用含a的代数式表达)。
(5)下列选项中,会造成实验结果偏大的是____________。 (选填序号)
①实验开始,未先通空气,即称量装置C; ②B中反应结束后,没有继续通空气;
③缺少装置A; ④缺少装置D;
⑤装置B中稀盐酸的滴加速率过快; ⑥装置C中的NaOH溶液浓度过大。
【答案】 水浴加热 (NH4)2SO4 过滤 取最后一次洗涤的滤出液少许,滴入盐酸酸化的BaCl2溶液,若无沉淀说明已洗涤干净,若有沉淀则说明未洗涤干净 NaOH溶液 碱石灰 防止空气中的CO2进入装置C n =(1-84a)/18a ②⑤
【解析】(1)步骤1必须将反应的温度控制在50℃,水浴加热受热均匀,易于控制,不高于100℃均可采用水浴加热,故较好的加热方法是水浴加热;氨水、硫酸镁、碳酸氢铵三者反应,除生成MgCO3·nH2O沉淀外,同时生成的产物还有(NH4)2SO4;(2)步骤2操作后得到沉淀和溶液B,应该是过滤、洗涤,检验沉淀A已洗涤干净的方法是取最后一次洗涤的滤出液少许,滴入盐酸酸化的BaCl2溶液,若无沉淀说明已洗涤干净,若有沉淀则说明未洗涤干净;(3)装置A除去空气中的二氧化碳,排除干扰,故盛放的溶液是NaOH溶液。装置D中盛放的固体是碱石灰,其作用是防止空气中的CO2进入装置C;(4)n(MgCO3)=n(CO2)=a mol,m(H2O)=(1.000-84a)g,n(H2O)=![]() ,故n=
,故n=![]() ;(5)①实验开始,未先通空气,即称量装置C,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小;②B中反应结束后,没有继续通空气;产生的二氧化碳没有全部排到C装置,使二氧化碳的质量偏小,引起结果偏大;③缺少装置A,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小;④缺少装置D,使外界空气中二氧化碳进入C装置吸收,使二氧化碳的质量偏大,引起结果偏小;⑤装置B中稀盐酸的滴加速率过快,产生的二氧化碳没有全部被C装置吸收,使二氧化碳的质量偏小,引起结果偏大;⑥装置C中的NaOH溶液浓度过大,C装置中NaOH溶液浓度过大,不会影响二氧化碳的质量,对结果没有影响。答案选②⑤。
;(5)①实验开始,未先通空气,即称量装置C,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小;②B中反应结束后,没有继续通空气;产生的二氧化碳没有全部排到C装置,使二氧化碳的质量偏小,引起结果偏大;③缺少装置A,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小;④缺少装置D,使外界空气中二氧化碳进入C装置吸收,使二氧化碳的质量偏大,引起结果偏小;⑤装置B中稀盐酸的滴加速率过快,产生的二氧化碳没有全部被C装置吸收,使二氧化碳的质量偏小,引起结果偏大;⑥装置C中的NaOH溶液浓度过大,C装置中NaOH溶液浓度过大,不会影响二氧化碳的质量,对结果没有影响。答案选②⑤。


科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL﹣1的CH3COOH溶液滴定20mL 0.1molL﹣1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7.已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确是( )
A.Ka=![]() B.V=
B.V=![]()
C.Ka=![]() D.Ka=
D.Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要应用。
(1)氯胺[NH2Cl(g)]是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,试写出其杀菌过程中与水反应的化学方程式________________。
(2)羟胺(NH2OH)是有机合成的常见还原剂。工业上可用硝酸.硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为________________。
(3)银氨溶液是检验醛基的重要试剂,其溶液中存在Ag(NH3)2+(aq)![]() Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq)
Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=________________。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=________________。
(4)水合肼(N2H4·H2O)常用作锅炉水的除氧剂。N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O![]() N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为________________,溶液中离子浓度由大到小的排列顺序为________________。
N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为________________,溶液中离子浓度由大到小的排列顺序为________________。
(5)氨是一种重要的氮肥。工业合成氨反应为:![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g),该反应的活化能Ea1=254kJ/mol。
NH3(g),该反应的活化能Ea1=254kJ/mol。
①查阅文献,相关化学键键能数据如下:
化学键 | H-H | N | N-H |
E/kJ·mol-1 | 436 | 946 | 391 |
则反应NH3(g)![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)的活化能Ea2=________________。
H2(g)的活化能Ea2=________________。
②一定条件下,1molN2与3.6molH2在密闭容器中充分反应,测得放出的热量为13.8kJ,则H2的转化率为________________,为提高原料的利用率,工业合成氨应该采取的措施是=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若H2S的燃烧热化学方程式为H2S(g)+aO2(g)=X+cH2O(1)△H,则X应为( )
A. S(s) B. SO2(g) C. SO3(g) D. SO3(1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠露置于空气中,观察到下列现象:
![]()
请回答下列问题:
(1)白色粉末的化学式是__________,过程②的化学方程式是_________。
(2)下列说法正确的是________。
A. 过程③为物理变化
B. 过程④是碳酸钠吸收空气中的CO2、水蒸气形成了碳酸氢钠
C. 过程⑤发生了分解反应
D. 整个变化过程中只有一个氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按如图所示装置进行实验(部分夹持仪器及加热装置未画出)。
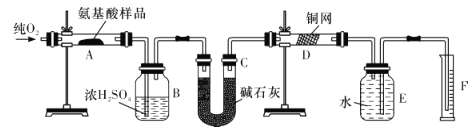
请回答下列有关问题:
(1)在安装E、F装置前,先要通入一段时间的氧气,其理由是_________。
(2)上述装置图中需要加热的仪器有________(填字母代号,下同),操作时应先点燃_____处的酒精灯。
(3)D装置的作用是_______________。
(4)A装置中发生反应的化学方程式是______________。
(5)读取N的体积时,应注意:①__________;②____________。
(6)实验中测得N2的体积为VmL(已折算成标准状况下)。为确定此氨基酸的分子式,还需要的有关数据有______(填字母代号)。
A.生成二氧化碳气体的质量 B.生成水的质量
C.通入氧气的体积 D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①2I2(s)+5O2(g)=2I2O5(s) ΔH=—1966 kJmol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=—1200 kJmol-1 。
则5CO(g)+I2O5(s)=5CO2(g)+I2(s)的△H= __________________________。
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:
① I2(s)+I-(aq)![]() I3-(aq) △H<0; ② I2 (s)+2I-(aq)
I3-(aq) △H<0; ② I2 (s)+2I-(aq)![]() I42-(aq)。
I42-(aq)。
温度降低时,反应①的平衡常数将______________(填“增大”“减小”或“不变”);反应②的平衡常数的表达式为K=__________________________。
(3)碘与钨在一定温度下,可发生如下可逆反应:W(s)+I2(g)![]() WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
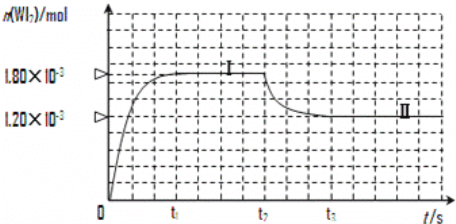
① 该反应△H____________0(填“>”或“<”)。
② 反应从开始到t1(t1= 3 min)时间内 I2 的平均反应速率v(I2)=_________。
③ 在450℃时,该反应的平衡常数K的值为__________________。
④ 能够说明上述反应已经达到平衡状态的有________________ (填选项字母)。
A.I2与WI2的浓度相等 B. 容器内各气体的浓度不再改变
C. 容器内混合气体的密度不再改变 D.容器内气体压强不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑在工业上应用价值广泛,它的一种提取工艺流程如下,请回答下列问题:
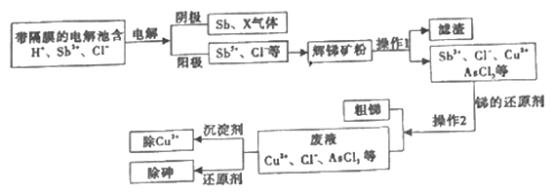
(1)辉锑矿是含锑的重要矿物,其主要成分是Sb2S3其中Sb的化合价是______。
(2)写出阳极区产物与辉锑矿粉主要成分发生反应的化学方程式______。
(3)电解池所用的“隔膜”宜采用______交换膜(填“阳离子”、“阴离子”或“质子”)。为促使Sb3+向阳极迁移加快反应,通常要进行的操作是_________。“电解” 中阴极反应的产物之一X是______。(填化学式)。
(4)为除去操作I所得滤液中的Cu2+,可加入Na2S。若滤液中c(Cu2+)= 0.01mol/L,当溶液中Cu2+恰好完全沉淀时,c(S2-)=______mol/L。 [已知Ksp(CuS)= 8×10-45]
(5)除去废液中的 AsCl3,是用次磷酸钠( NaH2PO2)还原AsCl3,产生了棕色单质砷沉淀和H3PO3。该反应中氧化剂和还原剂的物质的量之比为______,氧化产物是_____________。
(6)若电解池阴极得到1mol X气体,同时电路中转移6mole-,阴极生成的m( Sb)=____ g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com