
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abcB.bcdC.cbdD.abcd
【答案】D
【解析】
利用n=![]() ,以及阿伏加德罗定律和推论进行分析;
,以及阿伏加德罗定律和推论进行分析;
①甲烷的物质的量为![]() =0.3mol,②HCl的物质的量为
=0.3mol,②HCl的物质的量为![]() =0.5mol,③13.6gH2S的物质的量为
=0.5mol,③13.6gH2S的物质的量为![]() =0.4mol,④0.2molNH3,
=0.4mol,④0.2molNH3,
a、相同条件下,体积之比等于物质的量之比, 体积从大到小的顺序是②>③>①>④,故a正确;
b、根据阿伏加德罗推论,相同条件下,密度之比等于摩尔质量之比,因此密度大小顺序是②>③>④>①,故b正确;
c、四种物质的质量分别为0.3mol×16g·mol-1=4.8g、0.5mol×36.5g·mol-1=18.25g、13.6g、0.2mol×17g·mol-1=3.4g,质量大小顺序是②>③>①>④,故c正确;
d、个数比等于物质的量之比,氢原子的物质的量为1.2mol、0.5mol、0.8mol、0.6mol,原子个数大小顺序是①>③>④>②,故d正确;
综上所述abcd均正确,选项D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】目前海水液化可采用双极膜电液析法、同时获得副产品,其模拟工作原理如图所示。其中双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。M、N为离子交换膜。下列说法正确的是( )

A. X电极为电解池的阴极,该电极反应式为:2H+-2e-=H2↑
B. 电子流向:电源负极→X电极→Y电极→电源正极
C. 电路中每转移1mol电子,X、Y两极共得到标准状况下16.8L的气体
D. M为阳离子交换膜,A室获得副产品NaOH;若去掉B室双极膜,B室产物不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:NO+CO2![]() NO2+CO在密闭容器中进行,下列哪些条件加快该反应速率
NO2+CO在密闭容器中进行,下列哪些条件加快该反应速率
A. 增大体积使压强减小 B. 体积不变充人CO2使压强增大
C. 体积不变充人He气使压强增大 D. 压强不变充入N2使体积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO- + H+
CH3COO- + H+
(1)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+) 与0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。
(2)已知:25 ℃时,该电离平衡的平衡常数为1.75×10-5。
①求该温度时,a mol·L-1的醋酸溶液中c1(H+)=________________mol·L-1 (用含a的代数式表示)。[提示:此时电离度比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)为b mol·L-1,则此时c2(H+)=____________________mol·L-1(用含a、b的代数式表示)。
③c1(H+)________(填“大于”“小于”或“等于”)c2(H+)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用钒炉渣(主要含FeO·V2O5,还有少量SiO2、P2O5等杂质)提取V2O5的流程如下:

(1)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,该过程中被氧化的元素是_______________;浸出渣的主要成分为____________________(填化学式)。
(2)用MgSO4溶液除硅、磷时,滤渣的主要成分为__________。
(3)在焙烧NH4VO3的过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示,210℃时,剩余固体物质的化学式为_____________________。

(4)由V2O5冶炼金属钒采用铝热法,引发铝热反应的实验操作是__________________.
(5)将V2O5溶于足量稀硫酸得到250mL(VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000 mol·L-1H2C2O4标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+(黄色)被还原为VO2+(蓝色)。
①该滴定实验不需要另外加入指示剂,达到滴定终点的现象是___________________。
②(VO2)2SO4溶液中溶质的物质的量浓度为___________________。
③达到滴定终点时,俯视滴定管读数将使结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对一定量气体体积的探究。
已知1 mol不同气体在不同条件下的体积:
化学式 | 条件 | 1 mol气体体积/L |
H2 | 0 ℃,101 kPa | 22.4 |
O2 | 0 ℃,101 kPa | 22.4 |
CO | 0 ℃,101 kPa | 22.4 |
H2 | 0 ℃,202 kPa | 11.2 |
CO2 | 0 ℃,202 kPa | 11.2 |
N2 | 273 ℃,202 kPa | 22.4 |
NH3 | 273 ℃,202 kPa | 22.4 |
(1)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)___________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对一定量气体体积的探究。
已知1 mol不同气体在不同条件下的体积:
化学式 | 条件 | 1 mol气体体积/L |
H2 | 0 ℃,101 kPa | 22.4 |
O2 | 0 ℃,101 kPa | 22.4 |
CO | 0 ℃,101 kPa | 22.4 |
H2 | 0 ℃,202 kPa | 11.2 |
CO2 | 0 ℃,202 kPa | 11.2 |
N2 | 273 ℃,202 kPa | 22.4 |
NH3 | 273 ℃,202 kPa | 22.4 |
(1)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)___________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaH2PO2(次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等。一种利用泥磷(含P4和少量CaO、Fe2O3、Al2O3、CaCl2等)为原料制备NaH2PO2·H2O的工艺流程如下:
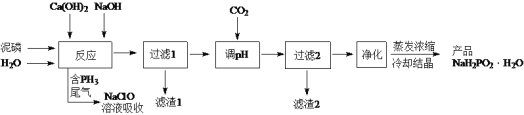
已知P4与两种碱的反应主要有:
Ⅰ. 2Ca(OH)2+P4+4H2O=2Ca(H2PO2)2+2H2↑
Ⅱ. 4NaOH + P4+8H2O = 4NaH2PO2·H2O+2H2↑
Ⅲ. 4NaOH + P4+2H2O = 2Na2HPO3 +2PH3↑
Ⅳ. NaH2PO2+NaOH = Na2HPO3+H2↑
(1)尾气中的PH3被NaClO溶液吸收生成NaH2PO2和NaCl的离子方程式为_____。
(2)“反应”在温度和水量一定时,混合碱总物质的量与P4的物质的量之比[n(碱)/ n(磷)]与NaH2PO2产率的关系如图所示。当n(碱)/ n(磷)>2.6时,NaH2PO2的产率随n(碱)/ n(磷)的增大而降低的可能原因是_____。

(3)通CO2“调pH”至溶液的pH约为_____,滤渣2主要成分为_____(填化学式)。
(4)“过滤2”的滤液须用Ag2SO4、Ba(OH) 2及Na2S溶液除去其中Cl-及Fe2+等,其中加入的Ag2SO4溶液不宜过量太多,其主要原因是_____。
(5)用NiCl2、NaH2PO2溶液化学镀Ni,同时生成H3PO4和氯化物的化学方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com