
【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0
【答案】D
【解析】
A.由表中数据可求得前4min内消耗Y为0.10mol,v(Y)=![]() ,所以V(Z)=2V(Y)=0.05mol/(Lmin),A错误;
,所以V(Z)=2V(Y)=0.05mol/(Lmin),A错误;
B.由表中数据可知7min时反应到达平衡,反应的三段式为
X(g) + Y(g) ![]() 2Z(g)
2Z(g)
起始浓度(mol/L)0.16 0.16 0
变化量(mol/L) 0.06 0.06 0.12
平衡浓度(mol/L)0.1 0.1 0.12
所以平衡常数K=![]() ,B错误;
,B错误;
C.其他条件不变,9min时是平衡状态,再充入1.6molX,平衡向正反应方向移动,再次达到平衡时Y的转化率增大,由于X加入量大于平衡移动消耗量,所以再次达到平衡时,X的浓度增大,C错误;
D.T1时,平衡常数K=1.44,降温到T2达到平衡时,平衡常数K2=4,说明降低温度平衡正向移动,使K增大,所以该反应正向为放热反应, D正确;
故合理选项是D。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素分别是元素周期表中三个连续短周期的元素,且原子序数依次增大。X、W同主族, Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键。![]() 原子的最外层电子数是次外层电子数的3倍,试推断:
原子的最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z两种元素的元素符号: X__________、Z__________。
(2)由以上元素中两两形成的化合物中,溶于水显碱性的气态氢化物的电子式为__________,它的共价键属于__________(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为__________;含有极性共价键和非极性共价键的化合物的电子式为_______。
(3)由X、Y、Z所形成的常见离子化合物是__________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为__________;W的单质与水反应时,水作__________(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z化合物的过程:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是制取溴苯的装置。回答下列问题:
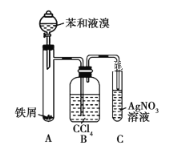
(1)装置A中发生反应的化学方程式是______________、______________。
(2)装置C中观察到的现象是______________,证明____________。
(3)装置B是吸收瓶,瓶内盛有CCl4,实验中观察到的现象是_________________,原因是___________________;如果没有装置B,将装置A、C直接相连,则该套实验装置_________(填“合理”或“不合理”),原因是___________。
(4)实验完毕后,将装置A试管中的液体倒入盛有冷水的烧杯中,烧杯_______(填“下”或“上”)层为溴苯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示从混合物中分离出X的两种方案,根据方案I和方案Ⅱ指出下列说法合理的是
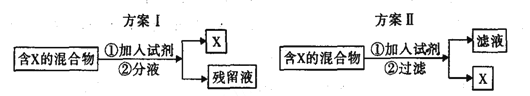
A.若含X的混合物为溴水,可通过方案I进行分离,加入试剂为CC14液体,充分振荡后液体分层,上层为X的CC14溶液
B.若含X的混合物为苯和苯酚,可通过方案Ⅱ进行分离,加入试剂为浓溴水,X为三溴苯酚
C.若含X的混合物为皂化反应后的混合物,可通过方案I进行分离,加入试剂为饱和食盐水,残留液中含有甘油
D.若含X的混合物为Fe、Al,可通过方案II进行分离,加入试剂为过量NaOH溶液,1mol X与足量氯气完全反应时,转移3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
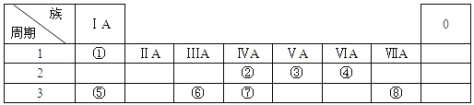
(1)化合物A是由⑤⑧两种元素构成的,用电子式表示其形成过程___________
(2)④、②元素形成的化合物的结构式__________
(3)②的最简单氢化物与氧气可以设计成燃料电池,写出在碱性条件下负极的电极方程式_____
(4)⑥的单质与⑤的最高价氧化物对应水化物的水溶液反应的离子方程式为:___________
(5)由①③⑧组成的M 物质中所含化学键的类型_________________
(6)M中的阳离子的鉴定方法是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.4000 mol·L1的NaOH溶液 | 称取4.0 g固体NaOH于250 mL容量瓶中,加入蒸馏水溶解,定容至刻度线即可。 |
B | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
C | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
D | 制备Fe(OH)3胶体 | 通常是将Fe(OH)3固体溶于热水中即可 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
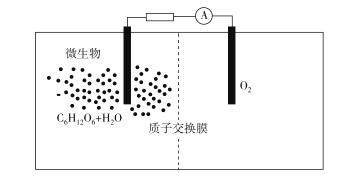
A. 负极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 正极反应式为O2+4e-+2H2O=4OH-
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com