
【题目】已知4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1。一定条件下,向1 L密闭容器中投入0.8 mol的NH3和1.6 mol的O2,发生上述反应,第2 min和第4 min时NH3的物质的量分别为0.6 mol和0.3 mol。下列说法中不正确的是
A. 上述反应的逆反应的活化能不小于905.9 kJ·mol-1
B. 反应在第2 min到第4 min时,O2的平均速率为0.15 mol·L-1·min-1
C. 反应第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
D. 平衡后降低压强,混合气体平均摩尔质量减小
【答案】B
【解析】
焓变=正反应的活化能-逆反应的活化能;第2 min和第4 min时NH3的物质的量分别为0.6 mol和0.3 mol,第2 min到第4 min时消耗氨气0.3mol,则消耗氧气0.375mol;第0 min和第2min时NH3的物质的量分别为0.8 mol和0.6 mol,氨气的变化量是0.2mol,第2 min到第4 min时氨气的变化量是0.3mol;平衡后降低压强,平衡正向移动,气体物质的量增大。
焓变=正反应的活化能-逆反应的活化能,所以逆反应的活化能不小于905.9 kJ·mol-1,故A正确;第2 min和第4 min时NH3的物质的量分别为0.6 mol和0.3 mol,第2 min到第4 min时消耗氨气0.3mol,则消耗氧气0.375mol,所以反应在第2 min到第4 min时,O2的平均速率为![]() 0.1875 mol·L-1·min-1,故B错误;第0 min和第2min时NH3的物质的量分别为0.8 mol和0.6 mol,氨气的变化量是0.2mol,第2 min到第4 min时氨气的变化量是0.3mol,反应第2 min时改变条件速率加快,所以改变的条件可能是使用催化剂或升高温度,故C正确;平衡后降低压强,平衡正向移动,气体物质的量增大,根据
0.1875 mol·L-1·min-1,故B错误;第0 min和第2min时NH3的物质的量分别为0.8 mol和0.6 mol,氨气的变化量是0.2mol,第2 min到第4 min时氨气的变化量是0.3mol,反应第2 min时改变条件速率加快,所以改变的条件可能是使用催化剂或升高温度,故C正确;平衡后降低压强,平衡正向移动,气体物质的量增大,根据![]() ,混合气体平均摩尔质量减小,故D正确;选B。
,混合气体平均摩尔质量减小,故D正确;选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图所示,试回答下列问题:

(1)图中ABCDE五点的KW间的大小关系是___________.(用ABCDE表示)
(2)若从A点到D点,可采用的措施是______.
a.升温
b.加入少量的盐酸
c.加入少量的NaOH固体
(3)点B对应温度条件下,某溶液pH═7,此时,溶液呈____(酸性、碱性、中性),点E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
(4)点B对应的温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是pH1+ pH2= ___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5时,发生以下两个分解反应:N2O5![]() N2O3+O2,N2O3
N2O3+O2,N2O3![]() N2O+O2,在1 L密闭容器中加热4 mol N2O5达到化学平衡时c(O2)为4.50 mol/L,c(N2O3)为1.62 mol/L,则在该温度下各物质的平衡浓度正确的是
N2O+O2,在1 L密闭容器中加热4 mol N2O5达到化学平衡时c(O2)为4.50 mol/L,c(N2O3)为1.62 mol/L,则在该温度下各物质的平衡浓度正确的是
A. c(N2O5)=1.44 mol/L B. c(N2O5)=0.94 mol/L
C. c(N2O)=1.40 mol/L D. c(N2O)=3.48 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】没食子酸丙酯简称PG,结构简式为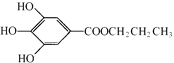 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.
(1)PG的分子式为___________,请写出PG分子中所含官能团的名称___________,1molPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量是___________。
PG可发生如下转化:

(2)A的结构简式为___________,1mol没食子酸最多可与___________mol H2加成.
(3)上图的有关变化中,属于氧化反应的有___________(填序号)。
(4)从分子结构或性质上看,PG具有抗氧化作用的主要原因是___________(填序号)
a.含有苯环 b.含有羧基 c.含有酚羟基 d.微溶于食用油
(5)反应④的化学方程式为:___________。
(6)B有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式:___________
i.含有苯环,且苯环上的一溴代物只有一种; ii.既能发生银镜反应,又能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
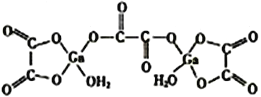
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
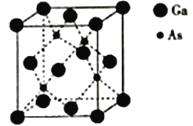
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)9.03×1023个CH4中,含____mol碳原子,___mol氢原子,___mol质子,____mol电子。与___个NH3含有相同数目的氢原子。
(2)与17gNH3所含有分子数相同的氧气的体积(标准状况)是_____L。
(3)某3.65g气体在标准状况下的体积是2.24L,则其摩尔质量是________。
(4)标准状况下9.03×1023个CH4所占的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质的溶液,pH由大到小的顺序是___________(填编号)。
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是_______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图。则HX的电离常数___________(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中水电离出来的c(H+)_________(填“大于”、“等于”或“小于”)醋酸溶液水电离出来的c(H+)。

(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=_______________________(填准确数值)。
(5)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时c mol/L的HX的电离度为a,试表示该温度下HX的电离平衡常数K=_____________________。(用含“ c、a的代数式表示”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/ (mol·L-1) | 0.44 | 0.6 | 0.6 |
(1)比较此时正.逆反应速率的大小:v正_______v逆(填“>”“<”或“=”)。
(2)若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=___________;该时间内反应速率v(CH3OH)=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com