
����Ŀ������VA��Ԫ���γɵĻ���������Ҫ�İ뵼�������Ӧ����㷺�����黯��(GaAs)���ش�����������
��1����̬Gaԭ�ӵĺ�������Ų�ʽΪ_____����̬Asԭ�Ӻ�����_________��δ�ɶԵ��ӡ�
��2����ʧȥ���ӵ�����������λ��kJ��mol-1������ֵ����Ϊ577��1984.5��2961.8��6192�ɴ˿���֪�ص���Ҫ���ϼ�Ϊ____��+3����ĵ縺�Ա���____��������������С������
��3���Ƚ������ص�±������۵�ͷе㣬������仯���ɼ�ԭ����________________________��
�ص�±���� | GaCl3 | GaBr3 | GaI3 |
�۵�/�� | 77.75 | 122.3 | 211.5 |
�е�/�� | 201.2 | 279 | 346 |
GaF3���۵㳬��1000�棬���ܵ�ԭ����___________________________________________��
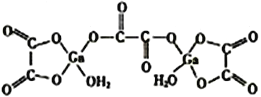
��4����ˮ�ϲ����صĽṹ��ͼ��ʾ��������ԭ�ӵ���λ��Ϊ______���������̼ԭ�ӵ��ӻ���ʽΪ______________��
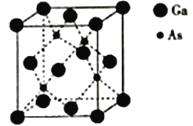
��5���黯���۵�Ϊ1238�棬���������ṹ��ͼ��ʾ����������Ϊa=565pm���þ��������Ϊ_________��������ܶ�Ϊ___________����NAΪ�����ӵ���������ֵ,�г���ʽ������g��cm-3��
���𰸡� [Ar]3d104s24p2(��1s22s22p63s23p63d104s24p1) 3 +1 �� GaCl3��GaBr3��GaI3���ۡ��е��������ߣ����Ǿ�Ϊ���Ӿ������ṹ���ơ���Է��������������������Ӽ�������������ǿ GaF3Ϊ���Ӿ��� 4 sp2 ԭ�Ӿ��� ![]()
����������1����������Ų�ʽ����д��Gaλ�ڵ�������IIIA�壬31��Ԫ�أ���˺�������Ų�ʽΪ [Ar]3d104s24p2(��1s22s22p63s23p63d104s24p1)��Asλ��VIA�壬������3��δ�ɶԵ��ӣ���2����������ܡ��縺�ԵĹ��ɣ����ݵ����ܵ���ֵ����һ��������ڶ����������ϴ����Ga�Ա��֣�1�ۣ�AsΪ�ǽ�����NiΪ���������As�ĵ縺�Ա�����3�����龧���۷иߵ��ɣ����ݱ�����ֵ�� GaCl3��GaBr3��GaI3 ���ۡ��е��������ߣ����Ǿ�Ϊ���Ӿ��壬�ṹ���ƣ���Է����������������Ӽ�������������ǿ��GaF3�۵�����������ߺܶ࣬˵��GaF3�������Ӿ��壻��4��������λ�����ӻ������жϣ����ݽṹͼ��Ga����λ��Ϊ4��Cԭ����3���������µ��Ӷԣ����C���ӻ�����Ϊsp2����5�����龧���ļ��㣬�þ����۵�ߣ�����ԭ�Ӿ��壬Gaλ�ڶ�������ģ�����Ϊ8��1/8��6��1/2=4,Asλ�ھ����ڲ���ԭ�Ӹ���Ϊ4����ѧʽΪGaAs������������Ϊ4��(70��75)NAg�����������Ϊ(565��10��10)cm3�������ܶ�Ϊ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�������ڵ�ij����Ԫ�أ����һ�����������������ͼ1��ʾ�����Ԫ����Ӧԭ�ӵ�M������Ų�ʽΪ________________��
(2)����ͼ2��ʾ��ÿ�����߱�ʾ���ڱ�IVA-VIIA�е�ijһ��Ԫ���⻯��ķе�仯��ÿ��С�ڵ����һ���⻯�����a���������____________��
(3)������(CH3)3N�����ᷴӦ����[(CH3)3NH]+���ù��������ɵĻ�ѧ��Ϊ__________(�����)��
a.���Ӽ� b.��λ�� c.��� d.�Ǽ��Թ��ۼ�
��������(CH3)3N������ˮ���Խ�����ԭ��__________��
(4)CO2�ڸ��¸�ѹ�����γɵľ����侧������ͼ3��ʾ���þ�����۵��SiO2����______(ѡ��ߡ��͡�)���þ�����̼ԭ�ӹ�����ӻ�����Ϊ____________��

(5)��ͼΪ20��̼ԭ����ɵĿ�����״����C20������״�ṹ��������������ι�����ͼ��C20������ÿ��̼ԭ��ֻ�����ڵ�3��̼ԭ���γɻ�ѧ����

��:C20���ӹ���____��������Σ�����______����ߡ�
(6)Cu2+�ȹ���Ԫ��ˮ�������Ƿ�����ɫ��ԭ�ӽṹ�йأ��Ҵ���һ���Ĺ��ɡ����ƶ�Ni2+��ˮ������Ϊ______(��С����ޡ�)ɫ���ӣ�������___________��
���� | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
��ɫ | ��ɫ | �Ϻ�ɫ | dz��ɫ | ��ɫ | ��ɫ |
(7)������й���ļ������Σ���������������ظ���Ԫ��Ϊ��������֪FexO���徧���ṹΪNaCl�ͣ����ھ���ȱ�ݣ�xֵС��1����֪FexO�����ܶ�Ϊp=5.71g/cm3�������߳�Ϊ4.28��10-10m��FexO��xֵ(��ȷ��0.01)Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ƿdz���DZ����ʳƷ���Ӽ������п���������������ṹ��ͼ��ʾ�������й���������ȷ����

A. ��������ķ���ʽΪC6H4O3
B. ���������ܷ����ӳɷ�Ӧ��������Ӧ
C. ����������������ʹ���Ը��������Һ��ɫ
D. ���������ụΪͬ���칹��ķ����廯������3������������O��O������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��δ������Դ���ص�����Դ�ḻ����ʹ��ʱ�Ի�������Ⱦ����Ⱦ��С���ҿ�����������������δ������Դ������
�ٵ����� ��ú ����Ȼ�� ��̫���� ���������� ��ʯ�� �߷��� ������
A. �ڢݢߢ� B. �٢ܢݢߢ� C. �ܢݢߢ� D. �ڢۢޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪HCl(g)��1/2H2(g)+1/2Cl2(g) ��H=+92.3kJ��mol-1����ӦH2(g)+Cl2(g)��2HCl(g)�ġ�HΪ
A. �D92.3kJ��mol-1 B. -184.6kJ��mol-1
C. �D369.2kJ��mol-1 D. +184.6kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����0.50 mol��L-1NaOH��Һ��0.50 mol��L-1������Һ�����к��ȵIJⶨ����ʵ���д�ԼҪʹ��245mL0.50 mol��L-1NaOH��Һ��
(1)����ʱ������Ҫ��������ƽ����NaOH����_________g��
(2)�ⶨϡ�����ϡ���������к��ȵ�ʵ��װ����ͼ��ʾ������˵����ȷ����_________
A����ͼ��ʾ���ⶨ�к���ʱ����С���ձ���������ֽ������ĭ���ϵ�Ŀ���ǹ̶�С�ձ�

B������50 mL 0.55 mol��L1������������Һ���ֱ���50 mL 0.50 mol��L1�������50 mL 0.50 mol��L1�������ַ�Ӧ������Ӧ�ⶨ���к������
C���к��Ȳⶨʵ��Ҳ������ϡ����������������Һ��Ӧ
D��Ϊ�˼�װ�ã��к��Ȳⶨʵ���еĻ��β���������������¶ȼƴ���
(3)д���÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽ�����к���Ϊ��H��-57.3 kJ��mol-1��_____________________��
(4)ȡ50 mLNaOH��Һ��30 mL������Һ����ʵ�飬ʵ���������±���
������� | ��ʼ�¶�t1/�� | ��ֹ�¶� t2/�� | �¶Ȳ�ƽ��ֵ ��t2��t1��/�� | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
�ٱ��е��¶Ȳ�ƽ��ֵΪ___________________�档
�ڽ�����Ϊ0��50 mol��L-1 NaOH��Һ��0��50 mol��L-1������Һ���ܶȶ���1 g��cm-3���кͺ�������Һ�ı�����c = 4.18 J����g���棩-1�����к��Ȧ�H=________________��ȡС�����һλ����
������ʵ����ֵ����릤H��-57.3 kJ��mol-1��ƫ�����ƫ���ԭ������ǣ�����ĸ��__________��
a��ʵ��װ�ñ��¡�����Ч����
b����ȡNaOH��Һ�����ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�������Һ�д��������һ���ǣ� ��
A.Mg2+��Al3+��Cl����OH��
B.Na+��Ba2+��OH����SO42��
C.K+��Na+��NO3����HCO3��
D.K+��NH4+��CO32����OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����м��㣬ֱ��д����������
(1)��״���£�2.24 L Cl2������Ϊ__________����__________����ԭ�ӡ�
(2)10.8g R2O5����ԭ�ӵ���ĿΪ3.01��1023�� ��Ԫ��R�����ԭ������Ϊ__________��RԪ��������__________��
(3)��ȼ����ʽ̼����þ��OH-��CO32������֮��Ϊ51��300�������������ӵ����ʵ���֮��Ϊ____________��
(4)���a gij�����к��еķ�����Ϊb����c g�������ڱ�״���µ������(��NAΪ�����ӵ�����)______________��
(5)��10 mL 1.00 mol/L Na2CO3��Һ��10 mL 1.00 mol/L CaCl2��Һ���ͣ�������Һ��Na+�����ʵ���Ũ��Ϊ__________��������Һ��Cl-�����ʵ���Ũ��Ϊ__________�����Ի��ǰ����Һ����ı仯����
(6)��״���£�3.4g NH3 �����Ϊ_______ �������״����_______ L H2S������ͬ��Ŀ����ԭ�ӡ�
(7)��֪CO��CO2��������������11.6g���ڱ�״���µ����Ϊ6.72L������������CO������Ϊ_______ ��CO2����ͬ״���µ����Ϊ_______ ��
(8)��CH4��O2����ɵĻ�����壬�ڱ���µ��ܶ���H2��14.5������û��������CH4��O2�������Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ���Ͻ�����100mLϡ�����У�����1.12L NO���壨��״��������Ӧ�����Һ�м���NaOH��Һ���������������ͼ��ʾ������˵������ȷ����

A. ��������Ͻ���þ������ B. ����������ҺŨ��Ϊ3mol/L
C. �������������������� D. ���������������ʵ���Ũ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com