
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①地热能 ②煤 ③天然气 ④太阳能 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能
A. ②⑤⑦⑧ B. ①④⑤⑦⑧ C. ④⑤⑦⑧ D. ②③⑥⑦⑧
科目:高中化学 来源: 题型:
【题目】有如下三个热化学方程式:
H2(g)+1/2O2(g)===H2O(g) ΔH=a kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=c kJ·mol-1
关于它们的下列表述正确的是( )
A. 它们都是吸热反应 B. a、b和c均为正值
C. 2b=c D. a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述错误的是
A. 28g 由N2 与CO组成的混合气体中所含的原子数为2NA
B. 78g Na2O2 中所含的阴离子数为NA
C. 0.1molSO2 与0.1molO2充分反应后生成的SO2分子数为0.1 NA
D. 0.1molCu溶于足量稀硝酸中,转移的电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH 2=b kJ/mol
CO2(g)+H2(g) ΔH 2=b kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH 3=c kJ/mol
2CO2(g) ΔH 3=c kJ/mol
(1)求反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为_______________。
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2Sx )分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
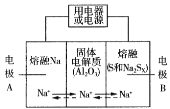
Na2Sx ![]() 2Na+xS (3<x<5)
2Na+xS (3<x<5)
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
(3)根据上表数据,判断该电池工作的适宜温度应为______________(填字母序号)。
A.100℃以下 B.100℃~300℃
C.300℃~350℃ D.350℃~2050℃
(4)关于钠硫电池,下列说法正确的是______(填字母序号)。
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为![]() 2e
2e![]() xS
xS
(5)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的c(OH-)=0.1mol/L时,电路中通过的电子的物质的量为_________mol,两极的反应物的质量差为_________g。(假设电解前两极的反应物的质量相等)
III.(6)在标准状态即压力为100kPa,一定温度下,由元素最稳定的单质生成生成 1mol 纯化合物时的反应热称为该化合物的标准摩尔生成焓(ΔfHΘm)。已知 100kPa,一定温度下:
Fe2 O 3(s+3C(石墨)=2Fe(s)+3CO(g) △H=+490.0 kJ/mol
CO(g)+1/2O2(g)=CO2 (g) △H=-280.0kJ/mol
C(石墨)+O2 ( g)=CO2 (g) △H=-390.5kJ/mol
则 Fe2O3 的标准摩尔生成焓ΔfHΘm=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的沸点是78℃,能与水以任意比混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3 溶液中几乎不溶,乙醚极易燃烧。实验室制醚的反应原理是:
2CH3CH2OH→H2O + CH3CH2—O—CH2CH3 (乙醚)
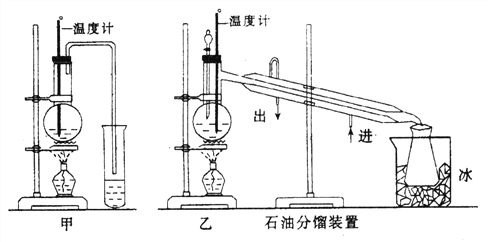
(1)甲图和乙图是两套实验室制乙醚的装置,选装置_________(填“甲”或“乙”)最合理,理由是______________________________。
(2)反应液中应加入沸石,其作用是____________________。
(3)反应中温度计的正确位置是水银球置于____________________。
(4)用装置乙制得的乙醚中可能含有大量的杂质,该杂质是__________,除去这种杂质的简易方法是__________________(提示:乙醚不溶于水,乙醇与水互溶)。
(5)如果温度太高,将会发生副反应,其产物名称为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
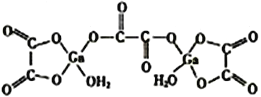
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
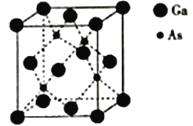
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由简单的烃可合成多种有机物

已知:
![]()
(1)A的结构简式为________________
(2)D所含的官能团名称为_______ ,B→C的反应类型_____________
(3)已知1molE在一定条件下和1mol H2反应成成F,写出E→F的化学方程式_____________________________________
(4)E的顺式结构简式为_____________________
(5)关于I的说法正确的是______________________
A.能与溴水发生加成反应 B.能发生酯化反应
C.核磁共振氢谱有3组吸收峰 D.能与NaHCO3溶液反应
(6)写出C与M反应的化学方程式_______________________________
(7)以CH3CHO为有机原料,选用必要的无机试剂合成CH3CHOHCHOHCH2OH,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,a、b、c、d、e、f 均为惰性电极,电解质溶液均足量。接通电源后,d 极附近显红色。下外说法正确的是

A. 电源B 端是正极
B. f 极附近红褐色变深,说明氢氧化铁胶粒带正电
C. 欲用丁装置给铜镀银,N 应为Ag,电解质溶液为AgNO3溶液
D. a、c电极均有单质生成它们的物质的量之比为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com