
【题目】由简单的烃可合成多种有机物

已知:
![]()
(1)A的结构简式为________________
(2)D所含的官能团名称为_______ ,B→C的反应类型_____________
(3)已知1molE在一定条件下和1mol H2反应成成F,写出E→F的化学方程式_____________________________________
(4)E的顺式结构简式为_____________________
(5)关于I的说法正确的是______________________
A.能与溴水发生加成反应 B.能发生酯化反应
C.核磁共振氢谱有3组吸收峰 D.能与NaHCO3溶液反应
(6)写出C与M反应的化学方程式_______________________________
(7)以CH3CHO为有机原料,选用必要的无机试剂合成CH3CHOHCHOHCH2OH,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)____________
【答案】 CH2=CH2 醛基 取代/水解 CH3CH=CHCHO+H2![]() CH3CH=CHCH2OH
CH3CH=CHCH2OH ![]() B、D
B、D 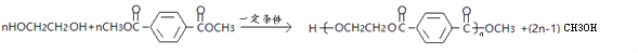

【解析】(1)A是M=28g/mol的烃,所以分子式C2H4,结构简式为CH2=CH2。
(2)根据图CH2=CH2被氧化生成的D,又根据信息![]()
D所含的官能团名称为醛基,B是CH2=CH2和溴加成的产物,根据条件氢氧化钠水溶液知
B→C的反应类型为取代/水解。
(3)已知E的结构为CH3CH=CHCHO在一定条件下和H2反应的化学方程式:CH3CH=CHCHO+H2![]() CH3CH=CHCH2OH 。
CH3CH=CHCH2OH 。
(4)E的结构为CH3CH=CHCHO,其顺式结构简式为![]() 。
。
(5)根据图推出I为苯甲酸,.不能与溴水发生加成反应,故错;有羧基能发生酯化反应,故B.正确;苯甲酸结构中有4种氢,核磁共振氢谱有4组吸收峰,故C错;有羧基能与NaHCO3溶液反应,故D对 。 答案:B D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①地热能 ②煤 ③天然气 ④太阳能 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能
A. ②⑤⑦⑧ B. ①④⑤⑦⑧ C. ④⑤⑦⑧ D. ②③⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。若实验中大约要使用245mL0.50 mol·L-1NaOH溶液,
(1)配制时至少需要用托盘天平称量NaOH固体_________g。
(2)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示,下列说法正确的是_________
A.如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯

B.若用50 mL 0.55 mol·L1的氢氧化钠溶液,分别与50 mL 0.50 mol·L1的盐酸和50 mL 0.50 mol·L1的硫酸充分反应,两反应测定的中和热相等
C.中和热测定实验也可以用稀硫酸与氢氧化钡溶液反应
D.为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替
(3)写出该反应中和热的热化学方程式:(中和热为ΔH=-57.3 kJ·mol-1)_____________________。
(4)取50 mLNaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
试验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①表中的温度差平均值为___________________℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c = 4.18 J·(g·℃)-1。则中和热ΔH=________________(取小数点后一位)。
③上述实验数值结果与ΔH=-57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的一组是( )
A.Mg2+、Al3+、Cl﹣、OH﹣
B.Na+、Ba2+、OH﹣、SO42﹣
C.K+、Na+、NO3﹣、HCO3﹣
D.K+、NH4+、CO32﹣、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学探究KI的化学性质。
(1)KI组成中含有钾元素,可知它能发生__________反应。
(2)①根据碘元素的化合价可推知KI有__________性。
②与KI反应,能体现上述性质的试剂有_________(填序号)
a、Fe2+ b、Fe3+ c、Br- d、Cl2
(3)兴趣小组的同学们猜测:Cu2+有可能氧化I-,为了验证,他们做了如下实验。(已知:CuI为不溶于水的白色沉淀)
操作 | 现象 |
| 溶液分层,上层显紫色,有白色沉淀生成 |
结论:Cu2+_________(填能或不能)氧化I-。若能氧化,写出反应的离子方程式_____________________ (若认为不能氧化,此空不用填写)。
(4)①同学们依据(3)的结论推测:Ag+能氧化I-,原因为___________。
他们做了如下实验进行探究
实验一:
操作 | 现象 |
| 生成黄色沉淀 |
②发生反应的化学方程式为_________________________________。
实验二:
操作 | 现象 |
| 3分钟后KI溶液开始变黄,随后溶液黄色加深,取出该烧杯中溶液滴入盛有淀粉溶液的试管,溶液变蓝。 |
③甲同学认为根据上述实验现象不能说明Ag+能氧化I-,原因是_______________________________。
乙同学在上述实验基础上进行了改进,并得出结论:Ag+能氧化I-。发生反应的离子方程式为____________________________________。
由以上两个实验得出的结论为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求进行计算,直接写出计算结果:
(1)标准状况下,2.24 L Cl2的质量为__________;有__________个氯原子。
(2)10.8g R2O5中氧原子的数目为3.01×1023, 则元素R的相对原子质量为__________;R元素名称是__________。
(3)阻燃剂碱式碳酸铝镁中OH-与CO32﹣质量之比为51:300,则这两种离子的物质的量之比为____________。
(4)如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______________。
(5)将10 mL 1.00 mol/L Na2CO3溶液与10 mL 1.00 mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为__________,则混和溶液中Cl-的物质的量浓度为__________(忽略混合前后溶液体积的变化)。
(6)标准状况下,3.4g NH3 的体积为_______ ;它与标准状况下_______ L H2S含有相同数目的氢原子。
(7)已知CO、CO2混合气体的质量共11.6g,在标准状况下的体积为6.72L,则混合气体中CO的质量为_______ ;CO2在相同状况下的体积为_______ 。
(8)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com