
【题目】下列各组离子中,能在溶液中大量共存的一组是( )
A.Mg2+、Al3+、Cl﹣、OH﹣
B.Na+、Ba2+、OH﹣、SO42﹣
C.K+、Na+、NO3﹣、HCO3﹣
D.K+、NH4+、CO32﹣、OH﹣
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH 2=b kJ/mol
CO2(g)+H2(g) ΔH 2=b kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH 3=c kJ/mol
2CO2(g) ΔH 3=c kJ/mol
(1)求反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为_______________。
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2Sx )分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
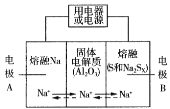
Na2Sx ![]() 2Na+xS (3<x<5)
2Na+xS (3<x<5)
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
(3)根据上表数据,判断该电池工作的适宜温度应为______________(填字母序号)。
A.100℃以下 B.100℃~300℃
C.300℃~350℃ D.350℃~2050℃
(4)关于钠硫电池,下列说法正确的是______(填字母序号)。
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为![]() 2e
2e![]() xS
xS
(5)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的c(OH-)=0.1mol/L时,电路中通过的电子的物质的量为_________mol,两极的反应物的质量差为_________g。(假设电解前两极的反应物的质量相等)
III.(6)在标准状态即压力为100kPa,一定温度下,由元素最稳定的单质生成生成 1mol 纯化合物时的反应热称为该化合物的标准摩尔生成焓(ΔfHΘm)。已知 100kPa,一定温度下:
Fe2 O 3(s+3C(石墨)=2Fe(s)+3CO(g) △H=+490.0 kJ/mol
CO(g)+1/2O2(g)=CO2 (g) △H=-280.0kJ/mol
C(石墨)+O2 ( g)=CO2 (g) △H=-390.5kJ/mol
则 Fe2O3 的标准摩尔生成焓ΔfHΘm=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
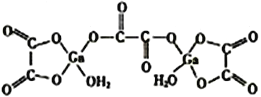
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
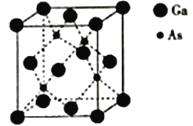
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示实验装置中,向盛有溶液①和溶液②的试管中,通入过量气体X,最终溶液①、溶液②均无沉淀生成的是:

选项 | 气体X | 溶液① | 溶液② |
A | SO2 | Ca(OH)2 | BaCl2 |
B | Cl2 | AgNO3 | Na2S |
C | NH3 | AgNO3 | AlCl3 |
D | HCl | Na2SiO3 | NaAlO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由简单的烃可合成多种有机物

已知:
![]()
(1)A的结构简式为________________
(2)D所含的官能团名称为_______ ,B→C的反应类型_____________
(3)已知1molE在一定条件下和1mol H2反应成成F,写出E→F的化学方程式_____________________________________
(4)E的顺式结构简式为_____________________
(5)关于I的说法正确的是______________________
A.能与溴水发生加成反应 B.能发生酯化反应
C.核磁共振氢谱有3组吸收峰 D.能与NaHCO3溶液反应
(6)写出C与M反应的化学方程式_______________________________
(7)以CH3CHO为有机原料,选用必要的无机试剂合成CH3CHOHCHOHCH2OH,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1 NaOH溶液以备使用。
Ⅰ.该同学应称取NaOH固体________g。容量瓶的使用之前需要_____。溶液的配置过程操作步骤如图2所示,则图1操作应在图2中的___(填选项字母)之间。操作②中液体转移到容量瓶要注意__________。图⑤操作的名称是________,进行该操作时要注意_________________。
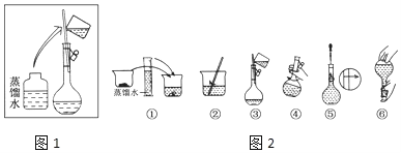
A.②与③ B.①与② C.④与⑤ D.⑤与⑥
Ⅱ.实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶
F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假定把![]() C的相对原子质量改为24,那么下列叙述错误的是
C的相对原子质量改为24,那么下列叙述错误的是
A. 此时16O的相对原子质量为32
B. NA个O2与NA个H2的质量比为16:1
C. N2的摩尔质量为56g/mol
D. 标准状况下,16g O2的体积约为5.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实
A. 苯不能使溴水褪色 B. 能与H2发生加成反应
C. 溴苯没有同分异构体 D. 邻二溴苯只有一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com