
【题目】Ⅰ.CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH 2=b kJ/mol
CO2(g)+H2(g) ΔH 2=b kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH 3=c kJ/mol
2CO2(g) ΔH 3=c kJ/mol
(1)求反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为_______________。
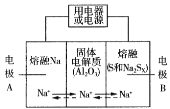
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2Sx )分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
Na2Sx ![]() 2Na+xS (3<x<5)
2Na+xS (3<x<5)
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
(3)根据上表数据,判断该电池工作的适宜温度应为______________(填字母序号)。
A.100℃以下 B.100℃~300℃
C.300℃~350℃ D.350℃~2050℃
(4)关于钠硫电池,下列说法正确的是______(填字母序号)。
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为![]() 2e
2e![]() xS
xS
(5)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的c(OH-)=0.1mol/L时,电路中通过的电子的物质的量为_________mol,两极的反应物的质量差为_________g。(假设电解前两极的反应物的质量相等)
III.(6)在标准状态即压力为100kPa,一定温度下,由元素最稳定的单质生成生成 1mol 纯化合物时的反应热称为该化合物的标准摩尔生成焓(ΔfHΘm)。已知 100kPa,一定温度下:
Fe2 O 3(s+3C(石墨)=2Fe(s)+3CO(g) △H=+490.0 kJ/mol
CO(g)+1/2O2(g)=CO2 (g) △H=-280.0kJ/mol
C(石墨)+O2 ( g)=CO2 (g) △H=-390.5kJ/mol
则 Fe2O3 的标准摩尔生成焓ΔfHΘm=__________________。
【答案】a +2b –2c 3CO + 3H2 ![]() CH3OCH3 + CO2 C AD 0.05 2.3 -821.5kJ/mol
CH3OCH3 + CO2 C AD 0.05 2.3 -821.5kJ/mol
【解析】
Ⅰ. (1).CH4(g)+2O2(g) ![]() CO2(g)+2H2O(g) ΔH 1=a kJ/mol,CO(g)+H2O(g)
CO2(g)+2H2O(g) ΔH 1=a kJ/mol,CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH 2=b kJ/mol,2CO(g)+O2(g)
CO2(g)+H2(g) ΔH 2=b kJ/mol,2CO(g)+O2(g) ![]() 2CO2(g) ΔH 3=c kJ/mol,根据盖斯定律分析,有①+②×2-③×2 即可得热化学方程式为CH4(g)+CO2(g)
2CO2(g) ΔH 3=c kJ/mol,根据盖斯定律分析,有①+②×2-③×2 即可得热化学方程式为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH = (a +2b –2c )kJ/mol。(2)根据反应物和生成物可知,参与大气循环的无机化合物为二氧化碳,根据原子守恒书写方程式为3CO + 3H2
2CO(g)+2H2(g) ΔH = (a +2b –2c )kJ/mol。(2)根据反应物和生成物可知,参与大气循环的无机化合物为二氧化碳,根据原子守恒书写方程式为3CO + 3H2 ![]() CH3OCH3 + CO2。Ⅱ. (3)原电池工作时,控制的温度应为满足钠和硫为熔融状态,则温度高于115℃而低于444.6℃,只有C符合题意。(4)A.放电时,钠被氧化,应为原电池的负极,故正确;B.阳离子向正极移动,即从A到B,故错误;C.A为负极,放电时发生氧化反应,充电时发生还原反应,连接电源负极,故错误;D.充电时,是电解池的反应,B为阳极,阳极反应为
CH3OCH3 + CO2。Ⅱ. (3)原电池工作时,控制的温度应为满足钠和硫为熔融状态,则温度高于115℃而低于444.6℃,只有C符合题意。(4)A.放电时,钠被氧化,应为原电池的负极,故正确;B.阳离子向正极移动,即从A到B,故错误;C.A为负极,放电时发生氧化反应,充电时发生还原反应,连接电源负极,故错误;D.充电时,是电解池的反应,B为阳极,阳极反应为![]() 2e
2e![]() xS,故正确。故选AD。(5)电解氯化钠溶液生成氢氧化钠、氢气和氯气,每生成2mol氢氧化钠转移2mol电子,当溶液中氢氧根离子浓度为0.1mol/L,生成氢氧化钠的物质的量为0.05mol,转移电子0.05mol,负极钠的质量减少1.15克,正极质量增加1.15克,两极的反应物的质量差为2.3克。 (6) ①Fe2 O 3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+490.0 kJ/mol,②CO(g)+1/2O2(g)=CO2 (g) △H=-280.0kJ/mol,③C(石墨)+O2 ( g)=CO2 (g) △H=-390.5kJ/mol,根据盖斯定律和标准摩尔生成焓的定义分析,由得③×3-①-②×3得2Fe(s)+ 3/2O2(g)= Fe2O3(s) △H==-390.5kJ/mol×3-490.0kJ/mol+280.0kJ/mol×3= -821.5kJ/mol。
xS,故正确。故选AD。(5)电解氯化钠溶液生成氢氧化钠、氢气和氯气,每生成2mol氢氧化钠转移2mol电子,当溶液中氢氧根离子浓度为0.1mol/L,生成氢氧化钠的物质的量为0.05mol,转移电子0.05mol,负极钠的质量减少1.15克,正极质量增加1.15克,两极的反应物的质量差为2.3克。 (6) ①Fe2 O 3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+490.0 kJ/mol,②CO(g)+1/2O2(g)=CO2 (g) △H=-280.0kJ/mol,③C(石墨)+O2 ( g)=CO2 (g) △H=-390.5kJ/mol,根据盖斯定律和标准摩尔生成焓的定义分析,由得③×3-①-②×3得2Fe(s)+ 3/2O2(g)= Fe2O3(s) △H==-390.5kJ/mol×3-490.0kJ/mol+280.0kJ/mol×3= -821.5kJ/mol。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式中ΔH表示可燃物燃烧热的是
A. CO(g)+1/2O2(g)===CO2(g) ΔH=-283 kJ·mol-1
B. CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
D. H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曲酸和脱氧曲酸是非常有潜力的食品添加剂,具有抗菌抗癌作用,其结构如图所示。下列有关叙述不正确的是

A. 脱氧曲酸的分子式为C6H4O3
B. 脱氧曲酸能发生加成反应和酯化反应
C. 曲酸和脱氧曲酸均能使酸性高锰酸钾溶液褪色
D. 与脱氧曲酸互为同分异构体的芳香族化合物有3种(不考虑—O—O—键)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银耳本身为淡黄色,某地出产一种雪耳,颜色洁白如雪,其制作过程如下:将银耳堆放在密封状况良好的塑料棚内,在棚的一端支一口锅,锅内放硫黄,加热使硫黄熔化并燃烧,两天左右雪耳就制成了。雪耳炖不烂,且对人体有害,制作雪耳利用的是( )
A.硫的还原性B.二氧化硫的漂白性C.二氧化硫的还原性D.硫的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①地热能 ②煤 ③天然气 ④太阳能 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能
A. ②⑤⑦⑧ B. ①④⑤⑦⑧ C. ④⑤⑦⑧ D. ②③⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCl(g)=1/2H2(g)+1/2Cl2(g) △H=+92.3kJ·mol-1,则反应H2(g)+Cl2(g)=2HCl(g)的△H为
A. ―92.3kJ·mol-1 B. -184.6kJ·mol-1
C. ―369.2kJ·mol-1 D. +184.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的一组是( )
A.Mg2+、Al3+、Cl﹣、OH﹣
B.Na+、Ba2+、OH﹣、SO42﹣
C.K+、Na+、NO3﹣、HCO3﹣
D.K+、NH4+、CO32﹣、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明强酸性溶液中,能大量共存的离子组是( )
A.K+、Cu2+、NO3﹣、SO42﹣
B.K+、Na+、Cl﹣、CO32﹣
C.Zn2+、NH4+、NO3﹣、Cl﹣
D.K+、Na+、MnO4﹣、SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com