
【题目】曲酸和脱氧曲酸是非常有潜力的食品添加剂,具有抗菌抗癌作用,其结构如图所示。下列有关叙述不正确的是

A. 脱氧曲酸的分子式为C6H4O3
B. 脱氧曲酸能发生加成反应和酯化反应
C. 曲酸和脱氧曲酸均能使酸性高锰酸钾溶液褪色
D. 与脱氧曲酸互为同分异构体的芳香族化合物有3种(不考虑—O—O—键)
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是
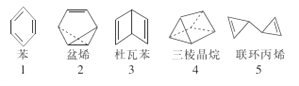
A. 1~5对应的结构中的一氯取代物只有1种的有3个
B. 1~5对应的结构均能使溴的四氯化碳溶液褪色
C. 1~5对应的结构中所有原子均可能处于同一平面的有1个
D. 1~5对应的结构均不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下三个热化学方程式:
H2(g)+1/2O2(g)===H2O(g) ΔH=a kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=c kJ·mol-1
关于它们的下列表述正确的是( )
A. 它们都是吸热反应 B. a、b和c均为正值
C. 2b=c D. a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。下列对实验现象的解释或推测不合理的是
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
A. a、d处:2H2O+2e-=H2↑+2OH-
B. b处:2Cl--2e-=Cl2↑,Cl2溶于水生成HClO,使溶液褪色
C. c处发生了反应:Fe-2e-=Fe2+
D. 根据实验一的原理,实验二中n处能析出O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述错误的是
A. 28g 由N2 与CO组成的混合气体中所含的原子数为2NA
B. 78g Na2O2 中所含的阴离子数为NA
C. 0.1molSO2 与0.1molO2充分反应后生成的SO2分子数为0.1 NA
D. 0.1molCu溶于足量稀硝酸中,转移的电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH 2=b kJ/mol
CO2(g)+H2(g) ΔH 2=b kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH 3=c kJ/mol
2CO2(g) ΔH 3=c kJ/mol
(1)求反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为_______________。
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2Sx )分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
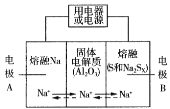
Na2Sx ![]() 2Na+xS (3<x<5)
2Na+xS (3<x<5)
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
(3)根据上表数据,判断该电池工作的适宜温度应为______________(填字母序号)。
A.100℃以下 B.100℃~300℃
C.300℃~350℃ D.350℃~2050℃
(4)关于钠硫电池,下列说法正确的是______(填字母序号)。
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为![]() 2e
2e![]() xS
xS
(5)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的c(OH-)=0.1mol/L时,电路中通过的电子的物质的量为_________mol,两极的反应物的质量差为_________g。(假设电解前两极的反应物的质量相等)
III.(6)在标准状态即压力为100kPa,一定温度下,由元素最稳定的单质生成生成 1mol 纯化合物时的反应热称为该化合物的标准摩尔生成焓(ΔfHΘm)。已知 100kPa,一定温度下:
Fe2 O 3(s+3C(石墨)=2Fe(s)+3CO(g) △H=+490.0 kJ/mol
CO(g)+1/2O2(g)=CO2 (g) △H=-280.0kJ/mol
C(石墨)+O2 ( g)=CO2 (g) △H=-390.5kJ/mol
则 Fe2O3 的标准摩尔生成焓ΔfHΘm=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
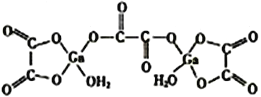
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
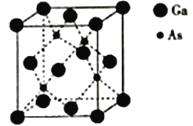
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假定把![]() C的相对原子质量改为24,那么下列叙述错误的是
C的相对原子质量改为24,那么下列叙述错误的是
A. 此时16O的相对原子质量为32
B. NA个O2与NA个H2的质量比为16:1
C. N2的摩尔质量为56g/mol
D. 标准状况下,16g O2的体积约为5.6L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com