
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。若实验中大约要使用245mL0.50 mol·L-1NaOH溶液,
(1)配制时至少需要用托盘天平称量NaOH固体_________g。
(2)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示,下列说法正确的是_________
A.如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯

B.若用50 mL 0.55 mol·L1的氢氧化钠溶液,分别与50 mL 0.50 mol·L1的盐酸和50 mL 0.50 mol·L1的硫酸充分反应,两反应测定的中和热相等
C.中和热测定实验也可以用稀硫酸与氢氧化钡溶液反应
D.为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替
(3)写出该反应中和热的热化学方程式:(中和热为ΔH=-57.3 kJ·mol-1)_____________________。
(4)取50 mLNaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
试验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①表中的温度差平均值为___________________℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c = 4.18 J·(g·℃)-1。则中和热ΔH=________________(取小数点后一位)。
③上述实验数值结果与ΔH=-57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】5.0 B NaOH(aq) + 1/2H2SO4(aq) ==1/2 Na2SO4(aq) + H2O(l) ΔH=-57.3 kJ/mol 4.0 -53.5KJ/mol acd
【解析】
(1) 要得到245mL0.50 mol·L-1NaOH溶液实际要配制250毫升溶液,即氢氧化钠的质量为0. 250L×0.50mol/L×40g/mol=5.0g。(2) A.测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是保温隔热,减少热量损失,故错误;B.中和热是指反应生成1mol水时的反应热,与用的酸碱的量无关,所以用50 mL 0.55 mol·L1的氢氧化钠溶液,分别与50 mL 0.50 mol·L1的盐酸和50 mL 0.50 mol·L1的硫酸充分反应,两反应测定的中和热相等,故正确;C.硫酸和氢氧化钡反应生成硫酸钡沉淀和水,沉淀析出和电离过程有热量的改变,所以该反应的热量不能计算中和热,故错误;D.温度计不能用于搅拌溶液,所以中和热测定实验中的环形玻璃搅拌棒不可以由温度计代替,故错误。故选B。(3)注意中和热是指反应生成1mol水的反应热,所以热化学方程式为:NaOH(aq) + 1/2H2SO4(aq) ==1/2 Na2SO4(aq) + H2O(l) ΔH=-57.3 kJ/mol。 (4)四次实验的温度差分别为3.5、4.0、3.9、4.1,由于第1次实验误差较大,则忽略第1次实验数据,取第2、3、4次的平均值,平均值为4.0。 (5) 氢氧化钠溶液的质量为50克,硫酸溶液的质量为30克,溶液的总质量为80克,反应生成0.025mol水,根据中和热计算公式计算,ΔH=- ![]() =-53.5KJ/mol。(6) a.实验装置保温、隔热效果差,会使测定的热量减少,结果变小,故正确;b.量取NaOH溶液的体积时仰视读数,会使氢氧化钠的体积变大,反应放出的热量偏多,则结果变大,故错误;c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,测定的温度变化小,则结果变小,故正确;d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,则硫酸的起始温度高,则温度差变小,则结果变小,故正确。故选acd。
=-53.5KJ/mol。(6) a.实验装置保温、隔热效果差,会使测定的热量减少,结果变小,故正确;b.量取NaOH溶液的体积时仰视读数,会使氢氧化钠的体积变大,反应放出的热量偏多,则结果变大,故错误;c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,测定的温度变化小,则结果变小,故正确;d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,则硫酸的起始温度高,则温度差变小,则结果变小,故正确。故选acd。


科目:高中化学 来源: 题型:
【题目】在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数之比为( )
A.1:1
B.2:1
C.1:2
D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述错误的是
A. 28g 由N2 与CO组成的混合气体中所含的原子数为2NA
B. 78g Na2O2 中所含的阴离子数为NA
C. 0.1molSO2 与0.1molO2充分反应后生成的SO2分子数为0.1 NA
D. 0.1molCu溶于足量稀硝酸中,转移的电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的沸点是78℃,能与水以任意比混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3 溶液中几乎不溶,乙醚极易燃烧。实验室制醚的反应原理是:
2CH3CH2OH→H2O + CH3CH2—O—CH2CH3 (乙醚)
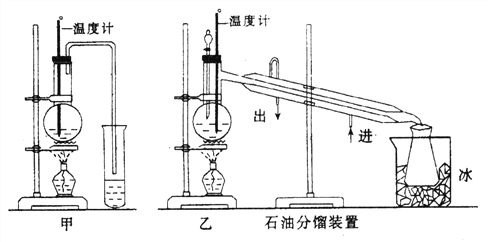
(1)甲图和乙图是两套实验室制乙醚的装置,选装置_________(填“甲”或“乙”)最合理,理由是______________________________。
(2)反应液中应加入沸石,其作用是____________________。
(3)反应中温度计的正确位置是水银球置于____________________。
(4)用装置乙制得的乙醚中可能含有大量的杂质,该杂质是__________,除去这种杂质的简易方法是__________________(提示:乙醚不溶于水,乙醇与水互溶)。
(5)如果温度太高,将会发生副反应,其产物名称为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
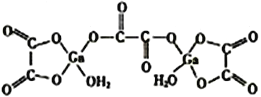
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
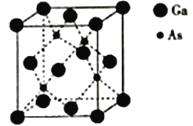
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由简单的烃可合成多种有机物

已知:
![]()
(1)A的结构简式为________________
(2)D所含的官能团名称为_______ ,B→C的反应类型_____________
(3)已知1molE在一定条件下和1mol H2反应成成F,写出E→F的化学方程式_____________________________________
(4)E的顺式结构简式为_____________________
(5)关于I的说法正确的是______________________
A.能与溴水发生加成反应 B.能发生酯化反应
C.核磁共振氢谱有3组吸收峰 D.能与NaHCO3溶液反应
(6)写出C与M反应的化学方程式_______________________________
(7)以CH3CHO为有机原料,选用必要的无机试剂合成CH3CHOHCHOHCH2OH,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以![]() 为原料制取
为原料制取![]() ,是化工生产环己酮的基本原理,根据下列合成路线填空:
,是化工生产环己酮的基本原理,根据下列合成路线填空:
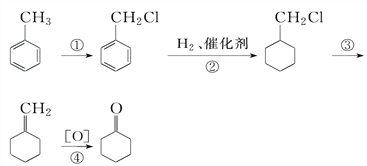
(1)反应①的条件是___________________________________________________,反应③的条件是_____________________________________________________。
(2)写出反应②③④的化学方程式并注明反应类型:
②________________________________________________________;
③____________________________________________________________;
④_________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物氟里昂—12的化学式是CF2Cl2,下面关于氟里昂—12的说法正确的是
A. 没有固定的熔沸点 B. 分子中的碳原子是饱和的
C. 属于正四面体的空间结构 D. 是甲烷的一种同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com