
����Ŀ�����ж�������ԭ��Ӧ�ķ����к������ǣ� ��
A. Mg���MgOʱ���ϼ����ߣ�ʧȥ���ӣ����Mg�ڸ÷�Ӧ�б���ԭ��
B. KMnO4���ȷֽ⣬MnԪ�ػ��ϼ�һ�������ߣ�һ���潵�ͣ����MnԪ�ؼȱ������ֱ���ԭ
C. CuSO4��2NaOH=Cu(OH)2����Na2SO4������������ԭ��Ӧ
D. ��Ӧ2H2O![]() 2H2����O2����H2O��HԪ�صĻ��ϼۼ������ߣ����н���
2H2����O2����H2O��HԪ�صĻ��ϼۼ������ߣ����н���
 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д� ��˼άС�ھ�100����ҵ��ϵ�д�
��˼άС�ھ�100����ҵ��ϵ�д� ��ʦָ��һ��ͨϵ�д�
��ʦָ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؼ�����(Rb)�������У���ȷ����( )
A. �����Ȼ��ʱ��������������ɫB. ������ǹ��ۻ����������ˮ
C. ���ơ��ء�����ֵ����У��ƵĽ�������ǿD. �������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ˮ�ĵ���ƽ��������ͼ��ʾ���Իش��������⣺

��1��ͼ��ABCDE����KW��Ĵ�С��ϵ��___________������ABCDE��ʾ��
��2������A�㵽D�㣬�ɲ��õĴ�ʩ��______��
a������
b����������������
c������������NaOH����
��3����B��Ӧ�¶������£�ij��ҺpH�T7����ʱ����Һ��____�����ԡ����ԡ����ԣ�����E��Ӧ���¶��£���pH=9��NaOH��Һ��pH=4��H2SO4��Һ��ϣ������û����Һ��pH=7����NaOH��Һ��H2SO4��Һ�������Ϊ________��
��4����B��Ӧ���¶��£���100���pH1=a��ijǿ����Һ��1���pH2=b��ijǿ����Һ��Ϻ���Һ�����ԣ�����ǰ����ǿ���pH1��ǿ���pH2֮��Ӧ����Ĺ�ϵ��pH1+ pH2= ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ⱦ�ѳ�Ϊ�������ٵ��ش���в�����ж�Ӧ��ϵ����ȫ��ȷ����
A.��������SO2��NO2��CO2��B.�⻯ѧ��������NO2��CxHy��CO��
C.����ЧӦ����CO2��CH4��D.��ɫ��Ⱦ����������ɫ���ѽ��������Ĥ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ij��Ӧ�����������仯��ͼ��ʾ, д���÷�Ӧ���Ȼ�ѧ����ʽ_____________________��

(2)����Һ�н��л�ѧ��Ӧ������,��״̬��Ϊ��aq��,��֪0.5mol��H2SO4����Һ������������������Һ��Ӧ�ų�57.3 kJ������,�����ӷ���ʽд���÷�Ӧ���Ȼ�ѧ����ʽ________________________��
(3)�ϳɰ���Ӧ���Ȼ�ѧ����ʽΪ:3H2(g)��N2(g)![]() 2NH3(g) ��H=��92.2kJ/mol����֪�ϳɰ���Ӧ��һ����Ӧ�ﲻ����ȫת��Ϊ������ķ�Ӧ,��ijһ��������N2��ת���ʽ�Ϊ10%,Ҫ��ͨ���÷�Ӧ�õ�92.2 kJ������,����Ҫ�ڷ�Ӧ�������Ͷ��_____mol N2��
2NH3(g) ��H=��92.2kJ/mol����֪�ϳɰ���Ӧ��һ����Ӧ�ﲻ����ȫת��Ϊ������ķ�Ӧ,��ijһ��������N2��ת���ʽ�Ϊ10%,Ҫ��ͨ���÷�Ӧ�õ�92.2 kJ������,����Ҫ�ڷ�Ӧ�������Ͷ��_____mol N2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�е�![]() �����ཡ�������Σ����Ϊ�˽�������ˮ��
�����ཡ�������Σ����Ϊ�˽�������ˮ��![]() ��Ũ�ȣ�ij����ˮ�о���Ա������ڼ��������������۽�
��Ũ�ȣ�ij����ˮ�о���Ա������ڼ��������������۽�![]() ��ԭΪN2���仯ѧ����ʽΪ10Al+6NaNO3+4NaOH===10NaAlO2+3N2��+2H2O��
��ԭΪN2���仯ѧ����ʽΪ10Al+6NaNO3+4NaOH===10NaAlO2+3N2��+2H2O��
��ش��������⣺
(1)������Ӧ�У�________Ԫ�صĻ��ϼ����ߣ����Ԫ�ص�ԭ��________(�����õ�������ʧȥ��)���ӣ���________Ԫ�صĻ��ϼ۽��ͣ����Ԫ�ص�ԭ�ӱ�________(����������������ԭ��)��
(2)����˫���ŷ�����ʾ��Ӧ�е���ת�Ƶķ������Ŀ��_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������N2O5ʱ���������������ֽⷴӦ��N2O5![]() N2O3��O2��N2O3
N2O3��O2��N2O3![]() N2O��O2����1 L�ܱ������м���4 mol N2O5�ﵽ��ѧƽ��ʱc(O2)Ϊ4.50 mol/L��c(N2O3)Ϊ1.62 mol/L�����ڸ��¶��¸����ʵ�ƽ��Ũ����ȷ����
N2O��O2����1 L�ܱ������м���4 mol N2O5�ﵽ��ѧƽ��ʱc(O2)Ϊ4.50 mol/L��c(N2O3)Ϊ1.62 mol/L�����ڸ��¶��¸����ʵ�ƽ��Ũ����ȷ����
A. c(N2O5)��1.44 mol/L B. c(N2O5)��0.94 mol/L
C. c(N2O)��1.40 mol/L D. c(N2O)��3.48 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ûʳ����������PG���ṹ��ʽΪ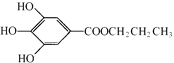 ���ǰ�ɫ��ĩ��������ˮ�����������͵���֬���dz��õ�ʳ���Ϳ���������
���ǰ�ɫ��ĩ��������ˮ�����������͵���֬���dz��õ�ʳ���Ϳ���������
��1��PG�ķ���ʽΪ___________����д��PG���������������ŵ�����___________��1molPG����������������Һ��ȫ��Ӧʱ�����ĵ��������Ƶ����ʵ�����___________��
PG�ɷ�������ת����

��2��A�Ľṹ��ʽΪ___________��1molûʳ����������___________mol H2�ӳɣ�
��3����ͼ���йر仯�У�����������Ӧ����___________(�����)��
��4���ӷ��ӽṹ�������Ͽ���PG���п��������õ���Ҫԭ����___________(�����)
a�����б��� b�������Ȼ� c�����з��ǻ� d������ʳ����
��5����Ӧ���Ļ�ѧ����ʽΪ��___________��
��6��B�ж���ͬ���칹�壬д�����з�������Ҫ���ͬ���칹��Ľṹ��ʽ��___________
i�����б������ұ����ϵ�һ�����ֻ��һ�֣� ii�����ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ������ƽ�ⳣ����
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.8��10��5 | K1��4.3��10��7 K2��5.6��10��11 | 3.0��10��8 |
�ش��������⣺
��1�����ʵ���Ũ��Ϊ0.1 mol/L�������������ʵ���Һ��pH�ɴ�С��˳����___________(����)��
a��Na2CO3 b��NaClO c��CH3COONa d��NaHCO3
��2��������0.1 mol/L��CH3COOH��Һ��ˮϡ���̣����б���ʽ������һ����С����_______��
A��c(H��) B��c(H��)/c(CH3COOH) C��c(H��)��c(OH��) D��c(OH��)/c(H��)
��3�����Ϊ10 mL pH��2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1 000 mL��ϡ����pH�仯��ͼ����HX�ĵ��볣��___________(����ڡ��������ڡ���С�ڡ�)����ĵ��볣����ϡ�ͺ�HX��Һ��ˮ���������c(H��)_________(����ڡ��������ڡ���С�ڡ�)������Һˮ���������c(H��)��

��4��25 ��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH��6������Һ��c(CH3COO��)��c(Na��)��_______________________(��ȷ��ֵ)��
��5������ƽ�ⳣ������ʵ��ķ����ⶨ�����ģ����Ѿ����25��ʱc mol/L��HX�ĵ����Ϊa���Ա�ʾ���¶���HX�ĵ���ƽ�ⳣ��K=_____________________�����ú��� c��a�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com