
【题目】1molX气体跟a molY气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g)![]() bZ(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是( )
bZ(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是( )
A. a=1,b=3 B. a=2,b=1 C. a=2,b=2 D. a=3,b=2
【答案】D
【解析】
1mol X气体跟a mol Y气体在体积可变的密闭容器中反应,反应达到平衡后,测得X的转化率为50%,则参加反应的X为0.5mol,则:
X(g)+a Y(g)![]() b Z(g)
b Z(g)
起始量(mol):1 a 0
变化量(mol):0.5 0.5a 0.5b
平衡量(mol):0.5 0.5a 0.5b
同温同压下,气体总质量不变,反应前后混合气体的密度之比和气体体积成反比,即和气体物质的量成反比,反应前混合气体的密度是反应后混合气体密度的![]() ,则反应前气体物质的量是反应后气体物质的量
,则反应前气体物质的量是反应后气体物质的量![]() ,则(1+a):(0.5+0.5a+0.5b)=4:3,整理得:2b=a+1,若a=1,则b=1,若a=2,则b=1.5,若a=3,则b=2,故选D。
,则(1+a):(0.5+0.5a+0.5b)=4:3,整理得:2b=a+1,若a=1,则b=1,若a=2,则b=1.5,若a=3,则b=2,故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下CH4、H2S、NH3均为气体,分别有①11.2L H2S②16g CH4③1.204×1024个NH3分子,下列物理量大小比较正确的是( )
A. 体积:②>③>①
B. 密度:③>②>①
C. 质量:③>②>①
D. 原子总数:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)在操作正确的前提下,提高中和热测定准确性的关键是_________
(2)做1次完整的中和热测定实验,温度计需使用________次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?__________,_____________________________
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒后驾车是马路上的第一大杀手。已知酒精(C2H5OH)能与K2Cr2O7和H2SO4的混合溶液在一定条件下发生如下反应:2K2Cr2O7+3C2H5OH+8H2SO4 2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,且知Cr2O72-和Cr3+在溶液中分别显橙色和绿色,回答下列问题:
(1)该反应________(填“是”或“不是”)离子反应。
(2)写出Cr2(SO4)3的电离方程式:______________________________________。
(3)该反应________(填“是”或“不是”)氧化还原反应,判断的依据是_________________________________。
(4)你认为能否用这一反应来检测司机是否酒后驾车?________(填“能”或“不能” ),简述其原理________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关煤的说法正确的是( )
A.煤的干馏、气化和液化都是物理变化
B.煤中含有苯、甲苯、二甲苯等芳香烃
C.通过煤的干馏可获得苯、甲苯等芳香烃
D.水煤气是通过煤的干馏得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________,可能含有的物质是________(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加___________________溶液的方法来检验。
(2)写出步骤③中的离子方程式__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到相应目的是
A | B | C | D | |
目的 | 比较AgCl和AgI的溶解度大小 | 研究浓度对化学平衡的影响 | 研究浓度对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收利用废旧锂离子电池正极材料锰酸锂LiMn2O4)的一种流程如下:
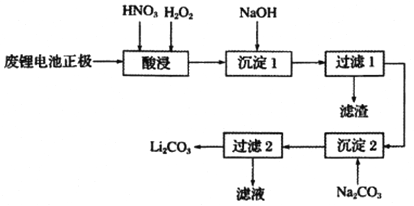
(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是_______________________________________________________。
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为 Mn ( NO3)2、LiNO3等产物。请写出该反应离子方程式:_________________________________。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是___________。
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是_________________________________。
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成 LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是______________________。
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入______________________。
(6)味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染。电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为85mA·cm-2下电解,180min内去除率达到98.22%。阳极发生的电极反应式是______________________;HClO氧化除去氨氮的反应离子方程式是_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com