
【题目】反应NH4HS (s)![]() NH3 (g)+H2S (g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
NH3 (g)+H2S (g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
A. 温度、容积不变时,通入HCl气体 B. 分离出一部分NH3
C. 容器体积不变,充入氮气 D. 保持压强不变,充入氮气
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________,可能含有的物质是________(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加___________________溶液的方法来检验。
(2)写出步骤③中的离子方程式__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述中正确的是
A. 0.1 molKI与0.1 molFeC13在溶液中反应转移的电子数为0.1NA
B. 镁条在氮气中完全燃烧,生成50g氮化镁时,有1.5NA共用电子对被破坏
C. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA
D. 标况时,22.4L二氯甲烷所含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收利用废旧锂离子电池正极材料锰酸锂LiMn2O4)的一种流程如下:
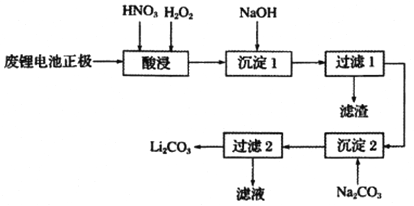
(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是_______________________________________________________。
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为 Mn ( NO3)2、LiNO3等产物。请写出该反应离子方程式:_________________________________。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是___________。
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是_________________________________。
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成 LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是______________________。
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入______________________。
(6)味精厂、化肥厂、垃圾渗滤液等排放的废水中往往含有高浓度的氨氮,若不经处理直接排放会对水体造成严重的污染。电化学氧化法:电化学去除氨氮主要是氯气和次氯酸的间接氧化作用。对某养猪场废水进行电化学氧化处理,选用IrO2-TiO2/Ti电极作为阳极,阴极采用网状钛板,加入一定量的NaCl,调节溶液的pH,在电流密度为85mA·cm-2下电解,180min内去除率达到98.22%。阳极发生的电极反应式是______________________;HClO氧化除去氨氮的反应离子方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积为2 L的密闭容器内(预先加入催化剂)通入2 mol NH3,经过一段时间达平衡后,测得容器内的压强为起始时的1.2倍。则NH3的转化率为
A. 25% B. 80% C. 10% D. 20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2NO2(g)![]() N2 O4(g);△H= -57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
N2 O4(g);△H= -57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A浅,C深
C.由状态A到状态B,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与浓硫酸在加热条件下发生反应。
(1)请同学们写出该反应方程式_______________________________________;
(2)其中______为还原剂,浓硫酸表现的性质__________(酸性、强氧化性、强氧化性和酸性);
(3)当3molCu参加反应,转移的电子数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列表格。
物质 | 分子数 | 质量 | 物质的量 | 摩尔质量 |
氮气 | _____ | 14 g | _____ | _____ |
硫酸 | 3.01×1022 | _____ | _____ | _____ |
水 | _____ | _____ | 0.5 mol | 18 g·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCN、CN-在溶液中存在下列平衡及其对应的平衡常数:①HCN![]() H++ CN- △H 1>0,K1 ②CN-+H2O
H++ CN- △H 1>0,K1 ②CN-+H2O ![]() HCN+OH- △H 2>0,K2,常温下(K1= 6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
HCN+OH- △H 2>0,K2,常温下(K1= 6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
A. 混合溶液的pH<7
B. 对混合溶液进行微热,K1 增大、K2 减小
C. K2≈ 1.6×10-5
D. c(Na+) = c(HCN) + c(CN—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com