
【题目】反应2NO2(g)![]() N2 O4(g);△H= -57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
N2 O4(g);△H= -57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A浅,C深
C.由状态A到状态B,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】 第三周期元素,浓度均为0.01 mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法正确的是
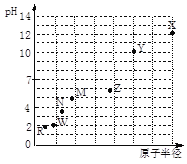
A. 气态氢化物的稳定性:N>R
B. Z的最高价氧化物对应的水化物能溶于稀氨水
C. Y和R形成的化合物既含离子键又含共价键
D. X和M两者最高价氧化物对应的水化物反应后溶液的pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa下,0.1 mol甲醇燃烧生成CO2和液态水时放热72.58 kJ,下列热化学方程式正确的是
A. CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=+725.8 kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1451.6 kJ/mol
C. CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
D. 2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1451.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4HS (s)![]() NH3 (g)+H2S (g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
NH3 (g)+H2S (g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
A. 温度、容积不变时,通入HCl气体 B. 分离出一部分NH3
C. 容器体积不变,充入氮气 D. 保持压强不变,充入氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/ (mol·L-1) | 0.44 | 0.6 | 0.6 |
(1)比较此时正.逆反应速率的大小:v正_______v逆(填“>”“<”或“=”)。
(2)若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=___________;该时间内反应速率v(CH3OH)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室要配制物质的量浓度为0.1 mol/L的NaOH溶液480 mL
(1)填表:
配制时应称量NaOH的质量/g | 已给仪器 | 配制时除已给仪器外还需要的其他仪器 |
__________ | 烧杯、药匙、托盘天平 | ____________________________ |
(2)若要计算该溶液溶质的质量分数,还需要的一个条件是______________(用文字说明)。
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是_________________(填字母)
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。

(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________。
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______;C中的现象是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下面的横线上填上适当的内容。
(1)6.02×1024个Na+约含有________mol Na+,其质量为________g。
(2)4.5 mol CH4约含有________个CH4,其质量为________g。
(3)3.01×1023个SO42-约含有________mol SO42-,其质量为________g;49 g H3PO4约含有________个H,________个P,________个O,共含有________个原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)据媒体报道,挪威和荷兰正在开发一种新能源盐能。当海水和淡水混合时,温度将升高0.1℃,世界所有入海口的这种能源相当于电力需求的20%。海水和淡水混合时,温度升高最可能的原因是______。
A.发生了盐分解反应
B.发生了水分解反应
C.由于浓度差产生放热
D.盐的溶解度增大
(2)蒸馏法是人类最早使用的淡化海水的方法。你认为蒸馏法淡化海水最理想的能源是_______。
(3)从海水中可得到多种化工原料和产品,如图是利用海水资源的流程图。

①反应Ⅱ的离子方程式为_________。
②从反应Ⅲ后的溶液中得到纯净的单质溴的实验操作方法是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com