
【题目】铜与浓硫酸在加热条件下发生反应。
(1)请同学们写出该反应方程式_______________________________________;
(2)其中______为还原剂,浓硫酸表现的性质__________(酸性、强氧化性、强氧化性和酸性);
(3)当3molCu参加反应,转移的电子数为_____________。
科目:高中化学 来源: 题型:
【题目】下列关于油和脂肪的说法正确的是( )
A.二者互为同分异构体B.二者仅状态不同,化学性质相同
C.前者熔点高,后者熔点低D.在一定条件下前者可转化为后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如下图所示(EMI+为有机阳离子)。
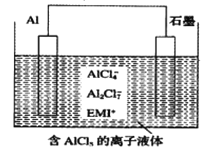
①Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) △H1=a kJ·mol-1
②3AlCl(g)===2A1(1)+AlCl3(g) △H2=b kJ·mol-1
③Al2O3(s)+3C(s)===2A1(1)+3CO(g) △H3
下列说法正确的是
A. 该电池放电时的负极反应方程式为A1-3e-+7AlCl4-===4A12C17-
B. ΔH2<0
C. 该电池充电时石墨电极与电源负极相连
D. A12O3(s)+3C(s)===2A1(1)+3CO(g) ΔH3=(a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4HS (s)![]() NH3 (g)+H2S (g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
NH3 (g)+H2S (g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
A. 温度、容积不变时,通入HCl气体 B. 分离出一部分NH3
C. 容器体积不变,充入氮气 D. 保持压强不变,充入氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若平衡体系A+B![]() C+D,增大压强时反应速率变化如图所示。则下列关于各物质状态的说法正确的是( )
C+D,增大压强时反应速率变化如图所示。则下列关于各物质状态的说法正确的是( )

A.A、B、C、D都是气体
B.C、D都是气体,A、B中有一种是气体
C.A、B都不是气体,C、D中有一种是气体
D.A、B都是气体,C、D中有一种是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室要配制物质的量浓度为0.1 mol/L的NaOH溶液480 mL
(1)填表:
配制时应称量NaOH的质量/g | 已给仪器 | 配制时除已给仪器外还需要的其他仪器 |
__________ | 烧杯、药匙、托盘天平 | ____________________________ |
(2)若要计算该溶液溶质的质量分数,还需要的一个条件是______________(用文字说明)。
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是_________________(填字母)
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。

(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________。
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______;C中的现象是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:
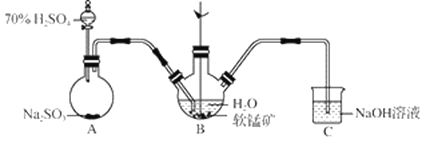
步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
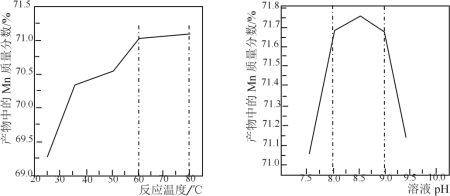
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所选装置或实验设计合理的是( )
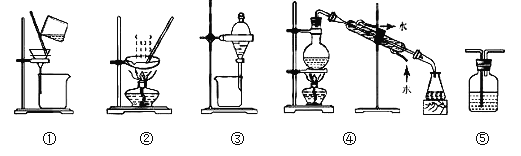
A. 用图①和②所示装置进行粗盐提纯
B. 用乙醇提取碘水中的碘选择图③所示装置
C. 用图④所示装置进行石油分馏实验制取汽油
D. 图⑤所示装置中盛有饱和Na2SO3溶液除去SO2中含有的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2 L的固定密闭容器中通入3 mol X气体,在一定温度下发生如下反应:2X(g)![]() Y(g)+3Z(g)。
Y(g)+3Z(g)。
(1)经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y表示的速率为________ mol·L-1·min-1。
(2)若向达到(1)的平衡体系中充入氦气,则平衡______(填“向左”、“向右”或“不”)移动;若从达到(1)的平衡体系中移走部分Y气体,则平衡________(填“向左”、“向右”或“不”)移动。
(3)若在相同条件下向达到(1)所述的平衡体系中再充入0.5 mol X气体,则平衡后X的转化率与(1)的平衡中X的转化率相比较________。
A.无法确定 B.前者一定大于后者 C.前者一定等于后者 D.前者一定小于后者
(4)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,则:a、b、c应该满足的关系为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com