
[2012·西安交大附中一模](10分)在学习了硝酸的强氧化性后,某学习小组进行了浓硝酸和硫单质反应的实验探究。他们根据氧化还原反应原理推测硫的氧化产物,提出三种假设:
I.只有H2SO4;
II.只有SO2;
III.SO2和H2SO4都有。
为了探究是哪一种情况,他们设计了下列实验流程及步骤:

①混合气体用水全部吸收后,测得无含硫、含氮化合物逸出,并将吸收液配成100.00mL溶液。
②取①中所得溶液20.00mL,加足量BaCl2溶液得白色沉淀0.466 g。
③再取20.00mL①中所得溶液,用NaOH溶液中和,恰好用去0.6 mol/LNaOH溶液30.00 mL。
请回答下列问题:
(1)混合气体中NO2气体被水充分吸收的反应方程式为__________ ____。
(2)①中配制溶液所用到的玻璃仪器除烧杯、量筒外还有______________;配制的100.00 mL溶液中H+的物质的量浓度是__________。
(3)收集到的气体中含有____ ___,假设_______(填“I、II或III”)成立;该实验中浓硝酸和硫反应的化学方程式为_____________________。
(10分)(1)4NO2+O2+2H2O=4HNO3
(2)玻璃棒、100mL容量瓶、胶头滴管 0.9mol/L
(3)NO2和SO2 III 14HNO3(浓) + 3S 2SO2↑+
H2SO4 + 14NO2 ↑+ 6H2O
2SO2↑+
H2SO4 + 14NO2 ↑+ 6H2O
【解析】(2)c(H+)=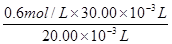 =0.9mol/L。
=0.9mol/L。
(3)SO2 ~ H2SO4 ~ BaSO4
1mol 1mol 233g
0.002mol 0.002mol 0.466g
n(H+)=n(HNO3)+2 n(H2SO4)=n(HNO3)+2×0.002mol=0.9mol/L×20.00×10-3L
解得n(HNO3) =0.014mol,n(NO2)=n(HNO3) =0.014mol
生成0.014mol NO2,N原子得到电子的物质的量为0.014mol;而生成0.002mol SO2,S原子失去电子的物质的量为0.008mol,根据电子守恒可知,氧化产物还应有H2SO4,其物质的量为(0.014mol﹣0.008mol)/6=0.001mol,再据原子守恒可写出该反应的化学方程式为:14HNO3(浓) + 3S 2SO2↑+ H2SO4
+ 14NO2 ↑+ 6H2O。
2SO2↑+ H2SO4
+ 14NO2 ↑+ 6H2O。


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源:2013届新课标高三配套月考(一)化学试卷(A卷)(带解析) 题型:填空题
[2012·西安交大附中一模](8分)A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
请回答下列问题:
(1)根据以上事实推断A—E的化学式:
A ;B ;C ;D ;E 。
(2)请用离子方程式表示A溶液显碱性的原因 。
(3)写出③、④的离子方程式:③ ;④ 。
查看答案和解析>>
科目:高中化学 来源:2013届新课标高三配套月考(四)化学试卷(A卷)(带解析) 题型:实验题
[2012·西安交大附中一模](10分)在学习了硝酸的强氧化性后,某学习小组进行了浓硝酸和硫单质反应的实验探究。他们根据氧化还原反应原理推测硫的氧化产物,提出三种假设:
I.只有H2SO4;
II.只有SO2;
III.SO2和H2SO4都有。
为了探究是哪一种情况,他们设计了下列实验流程及步骤:
①混合气体用水全部吸收后,测得无含硫、含氮化合物逸出,并将吸收液配成100.00mL溶液。
②取①中所得溶液20.00mL,加足量BaCl2溶液得白色沉淀0.466 g。
③再取20.00mL①中所得溶液,用NaOH溶液中和,恰好用去0.6 mol/LNaOH溶液30.00 mL。
请回答下列问题:
(1)混合气体中NO2气体被水充分吸收的反应方程式为__________ ____。
(2)①中配制溶液所用到的玻璃仪器除烧杯、量筒外还有______________;配制的100.00 mL溶液中H+的物质的量浓度是__________。
(3)收集到的气体中含有____ ___,假设_______(填“I、II或III”)成立;该实验中浓硝酸和硫反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新课标高三配套月考(二)化学试卷(A卷)(解析版) 题型:选择题
[2012·长安一中、高新一中、交大附中、师大附中、西安中学三模]X、Y是周期表前二十号元素 ,已知X、Y之间原子序数相差3 ,X、Y能形成化合物M。下列说法正确的是( )
A.若X、Y处于同一周期,则化合物M不可能是正四面体型分子晶体
B.若X的单质常温下是气体,则Y的单质常温下也是气体
C.若X、Y两元素周期数差1,则属于离子化合物的M只有四种
D.若M属于离子晶体,则其中可能含有非极性键
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新课标高三配套月考(一)化学试卷(A卷)(解析版) 题型:推断题
[2012·西安交大附中一模](8分)A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
请回答下列问题:
(1)根据以上事实推断A—E的化学式:
A ;B ;C ;D ;E 。
(2)请用离子方程式表示A溶液显碱性的原因 。
(3)写出③、④的离子方程式:③ ;④ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com