
【题目】某反应中反应物与生成物有:浓H2SO4、K2S、K2SO4、SO2、H2O和一种未知物质X。
(1)已知K2S在反应中失去电子,则该反应的氧化剂是_____,_____被氧化。
(2)已知0.5molK2S在反应中失去1mol电子生成X,则X的化学式为_____。
(3)按还原剂和氧化剂顺序将反应物填入下列空格中,配平,并标出电子转移的方向和数目:
![]() ___________________
___________________
(4)若反应中浓H2SO4过量,则产物中无X生成,请完成此反应的化学方程式:_____。在上述过程中,若有0.4mol浓硫酸被还原,反应中转移电子的物质的量为_____mol。
【答案】浓硫酸 K2S S 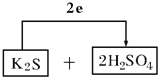 4H2SO4(浓)+K2S=K2SO4+4SO2↑+4H2O 0.8
4H2SO4(浓)+K2S=K2SO4+4SO2↑+4H2O 0.8
【解析】
(1)已知K2S在反应中失去电子硫元素化合价升高,则该反应的氧化剂为浓硫酸,硫元素化合价降低;
(2)已知0.5molK2S在反应中失去1mol电子生成X,浓硫酸被还原为二氧化硫,结合电子守恒计算分析硫元素化合价;
(3)计算得到K2S被氧化为S,浓硫酸被还原为SO2,电子转移依据元素化合价变化计算得到2e﹣;
(4)若反应中浓H2SO4过量产物中无S生成,说明硫化钾被氧化为二氧化硫,利用化学方程式定量关系计算若有0.4mol浓硫酸被还原,反应中转移电子的物质的量。
(1)反应物与生成物有:浓H2SO4、K2S、K2SO4、SO2、H2O和一种未知物质X,已知K2S在反应中失去电子硫元素化合价升高,则该反应的氧化剂为浓硫酸,硫元素化合价降低,K2S中硫元素化合价升高被氧化生成S;
故答案为:浓硫酸;K2S;
(2)已知0.5molK2S在反应中失去1mol电子生成X硫元素化合价为x,浓硫酸被还原为二氧化硫,结合电子守恒计算分析硫元素化合价,[x﹣(﹣2)]×0.5mol=1,x=0,则生成的X为S,
故答案为:S;
(3)计算得到K2S被氧化为S,浓硫酸被还原为SO2,电子转移依据元素化合价变化和电子守恒计算得到2e﹣,则氧化剂为浓硫酸和还原剂为K2S,配平后系数填入空格中,标出电子转移的方向和数目为: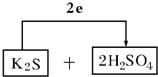 ;
;
故答案为: ;
;
(4)若反应中浓H2SO4过量产物中无S生成,同种元素不同价态间发生氧化还原反应最大程度发生归中反应,说明硫化钾被氧化为二氧化硫,反应的化学方程式为:4H2SO4(浓)+K2S=K2SO4+4SO2↑+4H2O,在上述过程中,3mol硫酸被还原,电子转移6mol电子,若有0.4mol浓硫酸被还原,反应中转移电子的物质的量为0.8mol;
故答案为:4H2SO4(浓)+K2S=K2SO4+4SO2↑+4H2O;0.8。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】翡翠是玉石中的一种,其主要成分为硅酸铝钠NaAl(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
(1)Cr3+电子排布式为______________________,基态Si原子中,电子占据的最高能层符号为______________________。
(2)翡翠中主要成分为硅酸铝钠,四种元素的第一电离能由大到小的顺序___________。
(3)锰的一种化合物的化学式为Mn(BH4)2(THF)3,THT的结构简式如图所示:

①THF中C原子的杂化轨道类型为___________,②BH4-的空间构型为___________
③NaBH4所含化学键类型有_____________
A、离子键 B、共价键 C、氢键 D、配位键
(4)MnO的熔点(1660℃)比MnS的熔点(1610℃)高,原因______________________。
(5)Ni可以形成多种氧化物,其中一种NixO晶体的晶胞结构为NaCl型,由于晶体缺陷,x为0.88,且晶体中Ni的存在形式为Ni2+、Ni3+,则晶体中N i2+和Ni3+最简整数比为___________,该晶体的晶胞参数为428pm,则晶体密度为___________g·cm-3(NA表示阿伏加德罗常数的值,列出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为____________________________。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示):________________________________________________________________________________________________________________________________________________;实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:_________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入盐酸目的是________________________________________。若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为___________________________________。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(S) ![]() Ag+(aq)+ Cl-(aq),在25℃时,氯化银的Ksp = 1.8×10-10mol2·L-2。现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是____________(填写序号)
Ag+(aq)+ Cl-(aq),在25℃时,氯化银的Ksp = 1.8×10-10mol2·L-2。现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是____________(填写序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸锂电池应用广泛, 电池放电后负极材料主要含有Li4Ti5O12、 铝箔及少量Fe, 可通过下列工艺流程回收钛、 锂。回答下列问题:

(1) Li4Ti5O12中, Ti元素的化合价为___, 滤液1中含金属的阴离子是___(填离子符号)。
(2) 酸浸时 Li4Ti5O12发生的反应是: Li4Ti5O12+7H2SO4+5H2O2=2Li2SO4+5[TiO(H2O2)]SO4+7H2O, 该反应是否属于氧化还原反应?___(填 “是” 或 “否”); 滤渣1是___。
(3) 向[TiO(H2O2)]SO4溶液中加入Na2SO3溶液发生反应的离子方程式为___。
(4) 向TiOSO4溶液中通入NH3发生反应的离子方程式为___。
(5) 沉淀TiO(OH)2用蒸馏水洗涤的目的是___。
(6) 萃取时, 温度对萃取率的影响如图所示。由图分析知实验时选择在常温下进行即可, 理由是__。

(7)“萃取” 和 “反萃取” 可简单表示为:[TiO(H2O2)]2++2(HA)2![]() [TiO(H2O2)](HA2)2+2H+,则反萃取过程中加入的试剂X是___。
[TiO(H2O2)](HA2)2+2H+,则反萃取过程中加入的试剂X是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A,B两种元素,A的+1价阳离子与B的-2价阴离子的电子层结构与氖相同。
(1)用电子式表示A与B两种元素构成的两种化合物分别为__________________和__________________,前者只有__________键;后者既有________键,又有________键。
(2)A的氢化物的电子式为_______,其中含有________键,它与水反应的化学方程式为____________。
(3)元素B的气态氢化物的电子式为___________________________________________,该分子中的键属于________(填“极性”或“非极性”)键,该氢化物与H+形成的键属于________。
(4)元素A的最高价氧化物的水化物的电子式为____________,其中既有________键,又有________键。
(5)B元素的单质有__________和__________,二者互称为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工产品,在基础化学试验中,有着重要的作用。
Ⅰ.物质的量浓度为18.4mol/L、质量分数为0.98的浓硫酸吸收水蒸气时,当其质量分数下降到0.87(密度1.8g/cm3)以下时,则失去干燥能力。质量分数为0.87的硫酸的物质的量浓度为_____(保留两位小数)。50mL8.4mol/L的浓硫酸作为干燥剂时,最多可吸水_____g.(保留两位小数)
Ⅱ.若用上述质量分数为0.98的硫酸,配制200mL物质的量浓度为0.46mol/L的硫酸,
(1)所需的浓硫酸的体积为_____mL,(保留一位小数)
(2)现有下列几种规格的仪器,本实验应选用_____(填序号);
①10mL量筒 ②50mL 量筒 ③100mL 量筒 ④100mL 容量瓶 ⑤200mL 容量瓶
(3)完成该实验除了烧杯外,还要的仪器有_____、_____;
(4)下列操作使所配溶液的物质的量浓度偏高的_____(填序号),对配制结果没有影响的是_____(填序号)。
a.用量筒量取浓H2SO4,慢慢地沿着玻璃棒注入盛有50mL蒸馏水的小烧杯,搅拌后,立即转移到容量瓶中。
b.往容量瓶转移溶液时,有少量液体溅出。
c.未洗涤稀释浓H2SO4的小烧杯。
d.定容时仰视。
e.容量瓶未干燥即用来配制溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol。A、C、D各为0.50mol,B的物质的量为x,当x的物质的量在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。达到平衡后,测得M的转化率为75%,填写空白:
![]()
(1)达到平衡后,反应器左室气体总的物质的量为____________________mol。
(2)若要使右室反应开始时V正>V逆,x的取值范围_____________________。
(3)若要使右室反应开始时V正<V逆,x的取值范围_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产氮化硅陶瓷反应为3SiCl4+2N2+6H2![]() Si3N4+12HCl,有关该反应说法正确的是
Si3N4+12HCl,有关该反应说法正确的是
A. SiCl4是氧化剂 B. N2发生还原反应
C. H2被还原 D. N2失电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化合物的治理是环保的一项重要工作,合理应用和处理氮的化合物,在生产生活中有着重要的意义。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+181.5 kJ·mol-1某科研小组尝试利用固体表面催化工艺进行NO的分解。若用●● 、●○ 、○○和![]() 分别表示N2 、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是___________(填字母序号)。
分别表示N2 、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是___________(填字母序号)。

(2)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H2=-1160 kJ/mol
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3
则△H3=___________。
(3)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g)![]() 2 ClNO(g) △H<0
2 ClNO(g) △H<0
①一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应,若该反应4min后达平衡,此时压强是初始的0.8倍,则平均反应速率v(Cl2)=___________mol·L-1·min-1。下列可判断反应达平衡状态的是___________(项序号字母)。
A 混合气体的平均相对分子质量不变
B 混合气体密度保持不变
C NO和Cl2的物质的量之比保持不变
D 每消耗1 moI NO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有___________(填选项序号字母)。
A 升高温度 B 缩小容器体积
C 再充入Cl2气体 D 使用合适的催化剂
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图(b)所示,当n(NO)/n(Cl2)=2.5时,达到平衡状态,ClNO的体积分数可能是图中D、E、F三点中的___________点。

(4)已知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)
N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)
②N2O2(g)+O2(g)![]() 2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1___________E2(填“>”、"<”或“=”):2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为___________。
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com