
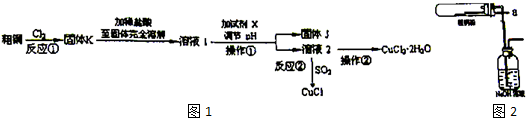
���� ��ͭ��������Fe����������Ӧ�����Ȼ������Ȼ�ͭ����ϡ�����ܽ⣬�γ��Ȼ������Ȼ�ͭ��Һ��ͬʱ�����Ȼ�ͭ���Ȼ���ˮ�⣬��Һ1�м���X������ҺpH���õ���Һ�ң�����ϵ�в����õ�CuCl2•2H2O������Һ2ΪCuCl2��Һ�������pHĿ����ʹ��Һ��������ת��ΪFe��OH��3���������˳�ȥ���Լ�X����ΪCuO��������ͭ�ȣ������Ŀ��Ϣ��֪���Ȼ�ͭ��Һ�����������ᣬ�����Ȼ�ͭˮ�⣬������Ũ������ȴ�ᾧ�õ�CuCl2•2H2O���پ������ˡ�ϴ�ӡ�����õ������ľ��壮
��1��ͭ��������ȼ�ղ�����ɫ�Ȼ�ͭ�̣�
��2���Ȼ�ͭ���Ȼ�������Һ�лᷢ��ˮ�⣬ͭ��ˮ������������ͭ��������Һ��ǿ���ԣ�����ͭ����ˮ����ʧ������pHĿ����ʹ��Һ��������ת��ΪFe��OH��3������
��3��ͭ��������������SO2�ǻ�ԭ��������CuCl��SO42-��
��4������������Һ���������������д������ƣ������ڴ������ƺ��������ƵĻ����Һ�з����绯ѧ��ʴ��̼������Ϊ��������Ϊ����������������ԭ��Ӧ����������������Ӧ�����ɫ����Ϊ����������������ClO-�õ�������Cl-��
��5��Cu2+�������ϵõ��ӣ�ͭԪ�صĻ��ϼۿ��Խ���+1�ۡ�0�ۣ�����CuCl������Cu2+�õ���������CuCl����ϵ���غ���ƽ��д�缫��Ӧ��
��� �⣺��1��ͭ��������ȼ�����ɹ����Ȼ�ͭ���۲쵽�ػ�ɫ���̣���ӦΪ��Cu+Cl2$\frac{\underline{\;��ȼ\;}}{\;}$CuCl2��
�ʴ�Ϊ��Cu+Cl2$\frac{\underline{\;��ȼ\;}}{\;}$CuCl2��
��2���Ȼ�ͭ���Ȼ����еĽ���������ˮ�⣬ֱ����ˮ��Һ������Һ��������ǣ����Լ���������������ܽ��Ȼ�ͭ���Ȼ������������Ȼ�ͭ���Ȼ���ˮ�⣻���ڵ���pH�Գ�ȥ��Һ1���ʿɼ��Լ��������ᷴӦ���Ҳ�����Cu2+֮������ӣ�����CuO��Cu2��OH����Cu2��OH��2CO3������pHĿ����ʹ��Һ��������ת��ΪFe��OH��3���������˳�ȥ���Ҳ������������ʣ�
�ʴ�Ϊ��c��
��3��������Ϣ��֪���ڼ��������£�SO2��ͭ���ӷ�Ӧ����CuCl��ɫ������SO42-���䷴Ӧ�����ӷ���ʽΪ��2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;��\;\;}}{\;}$2CuCl��+4H++SO42-��
�ʴ�Ϊ��2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;��\;\;}}{\;}$2CuCl��+4H++SO42-��
��4������������Һ���������������д������ƣ������ڴ������ƺ��������ƵĻ����Һ�з����绯ѧ��ʴ��̼������Ϊ��������Ϊ�����������ĵ缫��ӦʽΪFe-2e-=Fe2+��Fe2++2OH-=Fe��OH��2��4Fe��OH��2+O2+2H2O=4Fe��OH��3�������ĵ缫��ӦʽΪClO-+2e-+H2O=Cl-+2OH-�����ɫ����Ϊ����������
�ʴ�Ϊ��ClO-+2e-+H2O=Cl-+2OH-��
��5����ʯīΪ�缫�����CuCl2��Һʱ����������Ҳ���в���CuCl�������������ǵõ����ӷ�����ԭ��Ӧ��Cu2+�õ���������CuCl���缫��ӦΪ��Cu2++e-+Cl-=CuCl��
�ʴ�Ϊ��Cu2++e-+Cl-=CuCl��
���� ������ʵ�����Ʊ��Ȼ�ͭΪ���������������ʵ��Ʊ�ʵ����������Ӽ��顢�����ʡ����ӷ���ʽ����д��ԭ���ԭ����Ӧ�õȣ���Ŀ�漰��֪ʶ��϶࣬�����ڻ���֪ʶ���ۺ�Ӧ�õĿ��飬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������������Ҫ���л��ϳ��м��壬�㷺Ӧ���ڻ�ѧ��ҵ��ʵ����������ͼ��װ���Ʊ�����������
������������Ҫ���л��ϳ��м��壬�㷺Ӧ���ڻ�ѧ��ҵ��ʵ����������ͼ��װ���Ʊ�����������| ʵ���� | �Թܢ����Լ� | �Թܢ����Լ� | �л���� ���/cm |
| A | 2mL�Ҵ���1mL���ᡢ 1mL18mol•L-1 Ũ���� | ����Na2CO3 ��Һ | 3.0 |
| B | 2mL�Ҵ���1mL���� | 0.1 | |
| C | 2mL�Ҵ���1mL���ᡢ 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL�Ҵ���1mL���ᡢ���� | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
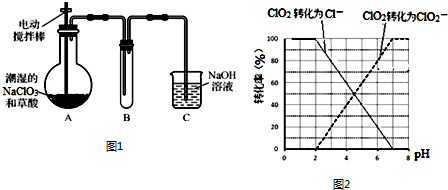
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
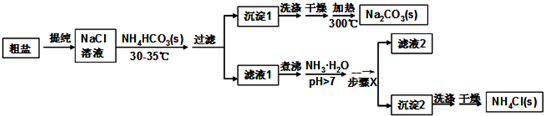
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ѧ�� | C-H | C-F | H-F | F-F |
| ����/��kJ•mol-1�� | 414 | 489 | 565 | 155 |
| A�� | +1940 kJ•mol-1 | B�� | -1940 kJ•mol-1 | C�� | -485 kJ•mol-1 | D�� | +485 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �к���һ����ǿ���ǿ�Ӧ�ų������� | |
| B�� | 1 mol����1 mol����ȫ��Ӧ�ų����������к��� | |
| C�� | ��ϡ��Һ�У��������кͷ�Ӧ����1 mol H2O��l��ʱ�ķ�Ӧ�Ƚ����к��� | |
| D�� | ��ʾ�к��ȵ����ӷ���ʽΪ��H+��aq��+OH-��aq��=H2O��l����H=57.3KJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ���У���ϩ����������Ӱ��÷�Ӧ�ķ�Ӧ�ʱ��H | |
| B�� | 0.5 mol H2O��l�� ��ȫ��Ӧ�ų�������Ϊ22.9 kJ | |
| C�� | 1 mol C2H5OH��g�������������1 mol C2H4��g����1 mol H2O ��g������������� | |
| D�� | 1 mol C2H4��g����1 mol H2O ��g���л�ѧ�����ܼ��ܴ���1 mol C2H5OH��g���л�ѧ�����ܼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ${\;}_{53}^{131}{I}$��ԭ�Ӻ������������������� | |
| B�� | ${\;}_{53}^{131}{I}$��ԭ������Ϊ131 | |
| C�� | ${\;}_{53}^{131}{I}$��ԭ�Ӻ��������Ϊ78 | |
| D�� | ${\;}_{53}^{131}{I}$�Ļ�ѧ������${\;}_{53}^{127}{I}$��ͬ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com