
| A. | ${\;}_{53}^{131}{I}$的原子核内中子数多于质子数 | |
| B. | ${\;}_{53}^{131}{I}$的原子序数为131 | |
| C. | ${\;}_{53}^{131}{I}$的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}{I}$的化学性质与${\;}_{53}^{127}{I}$不同 |
分析 A.I的质子数为53,中子数为131-53=78;
B.I的质子数为53;
C.质子数=核外电子数;
D.质子数相同,最外层电子数相同.
解答 解:A.I的质子数为53,中子数为131-53=78,则原子核内中子数多于质子数,故A正确;
B.I的质子数为53,而131为原子的质量数,故B错误;
C.质子数=核外电子数,则原子核外电子数为53,故C错误;
D.质子数相同,最外层电子数相同,则二者化学性质相同,故D错误;
故选A.
点评 本题考查原子结构与性质,为高频考点,把握原子中的数量关系、最外层电子数与元素性质的关系为解答的关键,侧重分析与应用能力的考查,注意原子的构成,题目难度不大.


 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着工业发展和社会的进步,人们日益关注环境污染问题.
随着工业发展和社会的进步,人们日益关注环境污染问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的CO2通入NaClO溶液中发生反应:NaClO+CO2+H2O=NaHCO3+HClO,说明酸性强弱的顺序为H2CO3>HClO>HCO3- | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 浓H2SO4具有强氧化性,常温下就能与金属Cu发生剧烈反应 | |
| D. | NO2与H2O 反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X属于非金属元素 | B. | 对应的氢化物的热稳定性:W>Y | ||
| C. | W与Z易于形成离子化合物 | D. | Z离子的氧化性强于X离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2HCl═CuCl2+H2↑ | B. | Al2O3+3H2O═2Al(OH)3 | ||
| C. | Mg(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ MgO+H2O | D. | Ba(OH)2+SO2═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 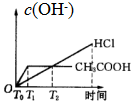 | B. | 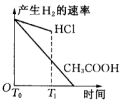 | C. |  | D. | 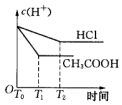 |
查看答案和解析>>
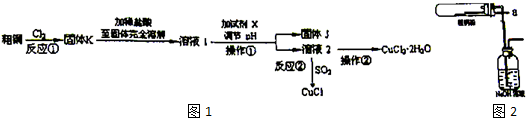
科目:高中化学 来源: 题型:解答题
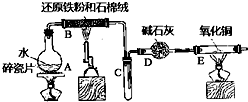 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com