
【题目】下列有机物中不属于天然高分子材料的是( )
A. 棉花 B. 淀粉 C. 尼龙 D. 羊毛
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】“摩尔盐”是分析化学中的重要试剂,化学式为(NH4)2Fe(SO4)2·6H2O。“摩尔盐”在一定条件下分解的方程式为:4[(NH4)2Fe(SO4)2·6H2O] ![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
(1)铁元素在元素周期表中的位置为________,其价层电子排布图为________。
(2)组成“摩尔盐”的非金属元素中第一电离能最大的元素为________。“摩尔盐”的分解产物中属于非极性分子的化合物是________。
(3)NH3的沸点比N2O的沸点________(填“高”或“低”),其主要原因是________。
(4)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中除了离子键以外还存在的化学键为________,与CN—互为等电子体的单质的分子式为_________。HCN分子中σ键和π键的个数之比为________。
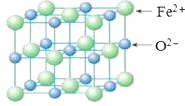
(5)FeO晶胞结构如下图所示,FeO晶体中Fe2+配位数为________,若该晶胞边长为acm,则该晶胞密度为________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 .
(2)烧杯间填满碎泡沫塑料的作用是 .
(3)理论上稀的强酸溶液与强碱溶液反应生成1mol水时放出57.3kJ的热量,写出表示稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:
(4)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”或“无影响”).
(5)实验中改用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由: .
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”“偏小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
NH4HCO3+NH3·H2O,经测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是( )
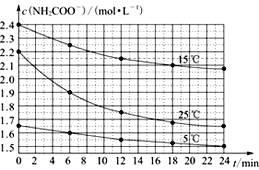
A. 0~12 min,初始浓度越大的实验,水解反应速率越大
B. c(NH2COO-)将随反应时间的不断延长而一直减小至0
C. 15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1
D. 25 ℃时0~6 min,v(NH2COO-)为0. 05 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据氧化还原反应Fe+2H+=Fe2++H2↑设计成原电池:
①负极材料为:发生的电极反应是: ,
电流(填“流出”或“流入”)
②正极发生的电极反应是:
该反应为(填“氧化反应”或“还原反应”)
③若电路中转移6.02×1022个e﹣ , 则产生标况下H2的体积为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 乙醇和乙酸都是常用调味品的主要成分
B. 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
C. 乙醇能发生氧化反应,而乙酸不能发生氧化反应
D. 乙醇和乙酸之间能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.物质的量就是1摩尔物质的质量
B.1 mol过氧化氢中含有2 mol氢和2 mol氧
C.1 mol H2中含有6.02个氢分子
D.NH3的摩尔质量是17 g· mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) △H=-a kJ.mol-1(a>0)。下列说法不正确的是
3Z(g) △H=-a kJ.mol-1(a>0)。下列说法不正确的是
A. 升高反应温度,逆反应速率增大,正反应速率增大
B. 达到化学平衡状态时,X、Y、Z的质量不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达akJ
D. X和Y充分反应生成Z的物质的量不可能达到3 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com