
【题目】绿原酸是一种新型高效的酚型天然抗氧化剂,在食品行业有着广泛的用途。其在酸性条件下发生如下反应,下列有关说法不正确的是
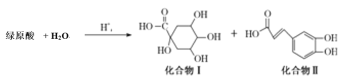
A.上述变化发生取代反应
B.1mol化合物I与足量金属钠反应生成标准状况下氢气体积为56L
C.1mol化合物II与浓溴水反应时,消耗4molBr2
D.1mol化合物II与足量的Na2CO3反应得到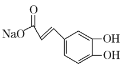
【答案】D
【解析】
由合成流程可知,绿原酸为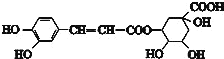 ,绿原酸水解生成化合物I、化合物II,据此分析解答。
,绿原酸水解生成化合物I、化合物II,据此分析解答。
A.根据分析,绿原酸为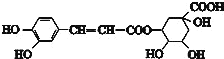 ,分子中含有酯基,在酸性条件下发生酯类的水解反应生成化合物I、化合物II,该反应过程为水解反应或取代反应,故A正确;
,分子中含有酯基,在酸性条件下发生酯类的水解反应生成化合物I、化合物II,该反应过程为水解反应或取代反应,故A正确;
B.化合物I含有4个OH和1个COOH,都可与钠反应生成氢气,1mol化合物I与足量金属钠反应,可生成2.5mol氢气,在标准状况下的体积为2.5mol×22.4L/mol=56L,故B正确;
C.化合物II含有酚羟基,可与浓溴水发生取代反应,含有碳碳双键,可与溴水发生加成反应,反应的方程式为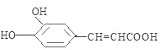 +4Br2→
+4Br2→ +3HBr,由反应可知,1mol化合物II与浓溴水反应时,消耗4molBr2,故C正确;
+3HBr,由反应可知,1mol化合物II与浓溴水反应时,消耗4molBr2,故C正确;
D.化合物II中含有酚羟基,具有苯酚的性质,可以与碳酸钠反应生成碳酸氢钠,自身转化为钠盐,含有羧基可以碳酸钠反应生成相应的钠盐、二氧化碳和水,则1mol化合物II与足量的Na2CO3反应得到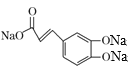 ,故D错误;
,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A. 稀硫酸滴在铁片上:2Fe+6H+===2Fe3++3H2↑
B. 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
C. 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+![]()
D. 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-===AgCl↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取a g样品,向其中加入足量的氢氧化钠溶液,测得生成的气体(标准状况,下同)体积为b L,样品中铝的质量是______________g。
(2)若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是:_______________________,氧化铁与铝的质量比是_____________。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c:b__________。
(4)用铝热法还原下列物质,制得金属各1mol,消耗铝最少的是____________
A.MnO2 B.Fe3O4 C.Cr2O3 D. V2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图装置(支撑仪器略去)探究乙醇的催化氧化反应。
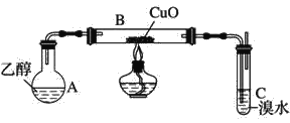
(1)实验开始时,对A进行水浴加热,其目的是__。
(2)B中反应方程式为__。
(3)若装置C中开始发生倒吸,则采取的应急措施是__(填编号)。
a.移去图中的酒精灯 b.将C中橡皮塞拔出
c.将B尾端的乳胶管取下 d.将A与B之间的乳胶管取下
(4)探究:充分反应后,观察到溴水完全褪色。学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br﹣)来确定乙醛使溴水褪色的原因。
①假设:请写出假设1的反应类型。
假设1:CH3CHO+Br2→CH2BrCHO+HBr__;
假设2:CH3CHO+Br2→CH3CHBrOBr 加成反应;
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr 氧化反应。
①结论:若实验测得n(Br2)=0.005mol,n(Br﹣)=0.01mol,则证明假设__正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知299 K时,合成氨反应 N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJB. 一定等于92.0 kJ
C. 一定小于92.0 kJD. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,其中,与高锰酸钾发生的反应是________反应(填反应类型,下同);与溴发生的反应是________反应。在一定的条件下,乙烯还能发生________反应,生成聚乙烯。
(2)一种能使溴水褪色的气态烃,标准状况下5.6 L的质量为10.5 g,10.5 g该烃完全燃烧时生成16 .8 L二氧化碳和13.5 g水。则该烃的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池常用于航天飞船,由电极反应产生的水经冷凝后可作为航天员的饮用水,其电极反应如下:
负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-
当得到1.8 kg饮用水时,电池内转移电子的物质的量为
A.1.8 mol
B.3.6 mol
C.100 mol
D.200 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代炼丹术中蕴含了丰富的化学知识,相关记载不绝于书。下列对炼丹术中相关记载的原理解释不正确的是
选项 | 相关记载 | 解释 |
A. | 《抱朴子》:“曾青(CuSO4)涂铁,铁赤色如铜……外变而内不化也。” | 发生了铁置换铜单质的反应 |
B. | 《吕氏春秋别类编》:“金(古代的‘金’往往指铜)柔锡柔,合两柔则刚。” | 合金的硬度大于组成它的纯 金属的硬度 |
C. | 《抱朴子》:“丹砂(HgS)烧之成水银,积变又还成丹砂。” | 发生了可逆反应:HgS |
D. | 《周易参同契》:“胡粉[2PbCO3·Pb(OH)2]投火中,色坏还为铅(Pb)。” | 此处的“火”中含有炭,将 胡粉发生分解反应生成的铅的氧化物还原为单质铅。 |
A.A B.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然石灰石是工业生产中重要的原材料之一,它的主要成分是 CaCO3,一般以CaO 的质量分数表示钙含量,常采用高锰酸钾法测定。步骤如下:
Ⅰ.称取 a g 研细的石灰石样品于 250 mL 烧杯中,加过量稀盐酸溶解,水浴加热 10 分钟;
Ⅱ.稍冷后逐滴加入氨水至溶液 pH≈4,再缓慢加入适量(NH4)2C2O4 溶液,继续水浴加热30 分钟;
Ⅲ.冷却至室温后过滤出沉淀,用另外配制的稀(NH4)2C2O4 溶液洗涤沉淀三次,再用蒸馏水洗涤至洗涤液中无法检出 Cl;
Ⅳ.加入适量热的稀硫酸至沉淀中,获得的溶液用 c mol·L1 KMnO4 标准溶液滴定至终点。
Ⅴ.平行测定三次,消耗KMnO4 溶液的体积平均为 V mL。
已知:H2C2O4 是弱酸;CaC2O4 是难溶于水的白色沉淀。
⑴Ⅰ中为了加快反应速率而采取的操作有_____。
⑵Ⅱ中加入氨水调节溶液 pH 的作用是_____。
⑶Ⅲ中洗涤得到干净的沉淀。
①结合平衡移动原理,解释用稀(NH4)2C2O4 溶液洗涤沉淀的目的__________________________。
②检测洗涤液中无 Cl的试剂和现象是__________________________。
③若沉淀中的 Cl未洗涤干净,则最终测量结果_____(填“偏大”、“偏小”或“不变”)。
⑷Ⅳ中用 KMnO4 标准溶液滴定。
①滴定时发生反应的离子方程式为_____。
②滴定至终点的现象为_____。
③样品中以CaO 质量分数表示的钙含量为_____(列出表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com