��������1�������H
2��ת���ʣ�Ӧʹƽ��������Ӧ�ƶ����ݴ˽�����������ƽ����Ӱ��������
������ѹǿ֮�ȵ������ʵ���֮�ȼ���ƽ��ʱ��Ӧ�������ܵ����ʵ����������ò���������μӷ�Ӧ�ĵ��������ʵ��������ö������N
2��ת���ʣ�
����Ӧ�����������С�ķ�Ӧ������ѹǿ�㶨���൱���ں��ݵ�����������ѹǿ��ƽ��������Ӧ���У�������ת��������
��2���ٰ�������������������һ��������ˮ����ƽ��д����ʽ��
��a���÷�Ӧ����Ӧ���������ʵ�����С�ķ�Ӧ�����º����������£�ѹǿ���䣬˵������ƽ�⣻
b������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�ƶ���
c�����������£���Ӧ�����������������䣬�ܶ�ʼ�ղ��䣻
d����ͼ��֪����t
2ʱ���ı�����ƽ��������Ӧ�ƶ���t
3ʱ����ƽ�⣬t
4ʱ˲������Ӧ���ʲ��䣬�淴Ӧ���ʼ�С��ƽ��������Ӧ���У�Ӧ��NO
2���͵�Ũ�ȣ�
�������¶�ƽ�����淴Ӧ���У�ƽ��ʱ���������ĺ��������¶�Խ�߷�Ӧ����Խ�죬����ƽ���ʱ��Խ�̣��ݴ�������������������ʱ���ϵ��ͼ���ݴ��жϣ�
��3���ٸ��ݸ�˹���ɣ�����֪�Ȼ�ѧ����ʽ�����ʵ���ϵ�����мӼ�����Ӧ��Ҳ������Ӧ��ϵ����������Ӧ�����㣻
�ڸ���n=
����NO
2�����ʵ�������Ӧ��ֻ��NO
2��NԪ�ػ��ϼ۷����仯�������绯��Ӧ��������NO
3-������ע���������������NO
3-�����ʵ������ٸ��ݵ���ת���غ����NԪ���ڻ�ԭ�����еĻ��ϼۣ��жϻ�ԭ����ݴ���д��
����⣺��1���١�a��ѡ���ʵ��Ĵ������ӿ췴Ӧ���ʣ���Ӱ��ƽ���ƶ���H
2��ת���ʲ��䣬��a����
b������ѹǿ��ƽ��������Ӧ�ƶ���H
2��ת��������b��ȷ��
c����ʱ�������ɵ�NH
3��������Ũ�Ƚ��ͣ�ƽ��������Ӧ�ƶ���H
2��ת��������c��ȷ��
d�������¶ȣ�ƽ�����淴Ӧ�ƶ���H
2��ת���ʽ��ͣ���d����
�ʴ�Ϊ��bc��
��ѹǿ֮�ȵ������ʵ���֮�ȣ��ﵽƽ��״̬ʱ�������ڵ�ѹǿ��ԭ����
������ٵ����ʵ���Ϊ��1+3��mol��
(1-)=
mol����
N
2��g��+3H
2��g��?2NH
3��g�� ���ʵ������١�n
1 2
n��N
2��
mol��n��N
2��=
=
mol�����Ե�����ת����=
��100%=12.5%��
����Ӧ�����������С�ķ�Ӧ������ѹǿ�㶨���൱���ں��ݵ�����������ѹǿ��ƽ��������Ӧ���У�������ת������������a
2��a
1��
�ʴ�Ϊ��12.5%������
��2���ٰ����Ĵ�������Ӧ����ʽΪ��4NH
3+5O
24NO+6H
2O���ʴ�Ϊ��4NH
3+5O
24NO+6H
2O��
��a���÷�Ӧ����Ӧ���������ʵ�����С�ķ�Ӧ�����º����������£�ѹǿ���䣬˵������ƽ�⣬��a��ȷ��
b������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�ƶ�����t
2ʱ�����������ʶ�����������Ӧ����������࣬ƽ��������Ӧ�ƶ����÷�Ӧ����Ӧ�����������С�ķ�Ӧ������ѹǿƽ��������Ӧ���У���t
2ʱΪ����ѹǿ����b����
c�����������£���Ӧ�����������������䣬�ܶ�ʼ�ղ��䣬���Բ���˵����Ӧ�ﵽƽ��״̬����c����
d����ͼ��֪����t
2ʱ���ı�����ƽ��������Ӧ�ƶ���t
3ʱ����ƽ�⣬t
4ʱ˲������Ӧ���ʲ��䣬�淴Ӧ���ʼ�С��ƽ��������Ӧ���У�Ӧ��NO
2���͵�Ũ�ȣ���������NO
2�����������t
3ʱֵ�����d��ȷ��
��ѡad��
�������¶�ƽ�����淴Ӧ���У�ƽ��ʱ���������ĺ��������¶�Խ�߷�Ӧ����Խ�죬����ƽ���ʱ��Խ�̣��ݴ�������������������ʱ���ϵ��ͼΪ
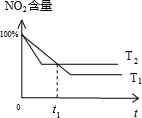
����ͼ��֪��t
1ʱ��a
1=a
2��t
1ʱ��֮ǰa
1��a
2��t
1ʱ��֮��a
1��a
2���ʴ�Ϊ��D��
��3������֪����2H
2��g��+O
2��g��=2H
2O��g����H=-483.5kJ/mol
��N
2��g��+2O
2��g��=2NO
2��g����H=+133kJ/mol
�ɸ�˹���ɿ�֪�����2-���4H
2��g��+2NO
2��g��=N
2��g��+4H
2O��g����
�ʡ�H=2����-483.5kJ/mol��-133kJ/mol=-1100kJ/mol��
���Ȼ�ѧ����ʽΪ��4H
2��g��+2NO
2��g��=N
2��g��+4H
2O��g����H=-1100kJ/mol��
�ʴ�Ϊ��4H
2��g��+2NO
2��g��=N
2��g��+4H
2O��g����H=-1100kJ/mol��
��9.2gNO
2�����ʵ���=
mol=0.2mol����Ӧ��ֻ��NO
2��NԪ�ػ��ϼ۷����仯�������绯��Ӧ��������NO
3-��
0.2mol��������ת�Ƶ��ӵ����ʵ�����0.1mol�������ɵ�NO
3-�����ʵ���Ϊ
=0.1mol���ʱ���ԭ�ĵ�ԭ�����ʵ���Ϊ0.2mol-0.1mol=0.1mol����NԪ���ڻ�ԭ�����еĻ��ϼ�Ϊx�ۣ���0.1mol����4-x��=0.1mol�����x=+3���ʻ�ԭ����ΪNO
2-�������ɵ�NO
3-��NO
2-���ʵ���֮��Ϊ1��1��ͬʱ��Ӧ����CO
2���ʶ���������̼������Һ��Ӧ�����ӷ�Ӧ����ʽΪ��2NO
2+CO
32-=NO
3-+NO
2-+CO
2���ʴ�Ϊ��2NO
2+CO
32-=NO
3-+NO
2-+CO
2��

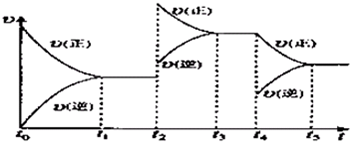
 ����ͼ��֪��t1ʱ��a1=a2��t1ʱ��֮ǰa1��a2��t1ʱ��֮��a1��a2���ʴ�Ϊ��D��
����ͼ��֪��t1ʱ��a1=a2��t1ʱ��֮ǰa1��a2��t1ʱ��֮��a1��a2���ʴ�Ϊ��D��

 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
 ��һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g��
��һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g�� FeO��s��+CO��g������H��0
FeO��s��+CO��g������H��0