
【题目】实验室利用下图装置用乙醇和浓硫酸反应制取乙烯,再用乙烯与溴的四氯化碳溶液反应制备1,2-二溴乙烷。
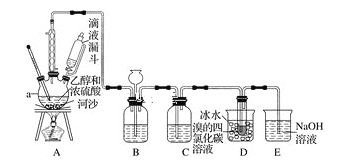
(1)在装置A中,生成的气体除乙烯外还有乙醚、CO2、SO2等,则生成乙烯的化学方程式为______________,河沙的作用是________________。仪器a的名称为________________________。
(2)装置B可起到安全瓶的作用,若气压过大,该装置中出现的现象为___________。
(3)装置C可除去CO2、SO2,所盛放的溶液为________________________。
(4)装置D中进行的主要反应的化学方程式为____________________________;把试管置于盛有冰水的小烧杯中的目的是_______________________________。
【答案】CH3CH2OH![]() CH2=CH2↑+H2O 防止液体暴沸 三颈烧瓶 漏斗中的液面上升 NaOH溶液 CH2=CH2+Br2→BrCH2=CH2Br 减少溴的挥发损失
CH2=CH2↑+H2O 防止液体暴沸 三颈烧瓶 漏斗中的液面上升 NaOH溶液 CH2=CH2+Br2→BrCH2=CH2Br 减少溴的挥发损失
【解析】
根据实验室制取乙烯的反应原理进行解答;根据杂质的性质选择除杂试剂。
(1)装置A是乙醇和浓硫酸反应制取乙烯的发生装置,则生成乙烯的化学方程式为CH3CH2OH![]() CH2=CH2↑+H2O ;河沙的作用是防止液体暴沸;仪器a的名称为三颈烧瓶。答案:CH3CH2OH
CH2=CH2↑+H2O ;河沙的作用是防止液体暴沸;仪器a的名称为三颈烧瓶。答案:CH3CH2OH![]() CH2=CH2↑+H2O;防止液体暴沸 ;三颈烧瓶;
CH2=CH2↑+H2O;防止液体暴沸 ;三颈烧瓶;
(2)装置B可起到安全瓶的作用,若气压过大,该装置中出现的现象为漏斗中的液面上升;答案:漏斗中的液面上升;
(3) CO2、SO2都属于酸性氧化物,可以和碱反应,所以装置c可盛放NaOH溶液,目的除去CO2、SO2气体;答案:NaOH溶液。
(4)装置D中是溴的四氯化碳溶液,能和乙烯发生加成反应,其反应的化学方程式为CH2=CH2+Br2→BrCH2=CH2Br;液溴具有挥发性,所以把试管置于盛有冰水的小烧杯中,可以减少溴的挥发,答案:CH2=CH2+Br2→BrCH2=CH2Br;减少溴的挥发损失。


科目:高中化学 来源: 题型:
【题目】1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A. Na2CO3 B. Na2O2、Na2CO3
C. NaOH、Na2CO3 D. Na2O2、NaOH、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5gHCl溶解在1L水中(水的密度近似为1 gmL-1),所得溶液的密度为ρ gmL-1,质量分数为w,物质的量浓度为c gmL-1,NA表示阿伏加德罗常数,下列说法正确的是( )
A.所得溶液的物质的量浓度:c=1 gmL-1
B.所得溶液中含有NA个HCl分子
C.36.5 gHCl气体占有的体积为22.4L
D.所得溶液的质量分数: w=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:①16H++10Z-+2![]() ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
A.氧化性强弱顺序为:![]() <Z2<R2<M3+
<Z2<R2<M3+
B.还原性强弱顺序为:X2+<Z-<R-<M2+
C.Z元素在反应①中被氧化,在③中被还原
D.常温下可发生反应2M2++Z2===2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A. 1 mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应
B. 该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C. 该有机物遇硝酸银溶液产生白色沉淀
D. 该有机物在一定条件下能发生消去反应或取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有:

(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是____。
(2)反应②中还原剂是________。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。
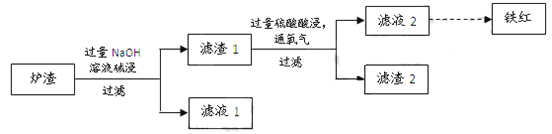
① 炉渣碱浸时反应的离子方程式是_____、_____。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是________;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁与稀硝酸的反应为:Mg+ HNO3(稀)—— Mg(NO3)2+ NO↑+ H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目。________
(2)该反应中,还原产物是_________,HNO3表现了______________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学把小块木炭在酒精灯上烧至红热,迅速投入热的浓硝酸中,发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧发出亮光。经查阅资料可知浓硝酸分解产生NO2和O2。为了探究“液面上木炭迅速燃烧发出亮光”的原因,该小组同学用如图装置完成以下实验:
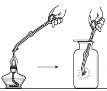
序号 | 实验I | 实验II |
集气瓶中所盛气体 | O2 | 加热浓硝酸 产生的气体 |
现象 | 木炭迅速燃烧发出亮光 | 木炭迅速燃烧发出亮光 |
下列说法正确的是
A. 浓硝酸分解产生的V(NO2):V(O2)=1:1
B. 红棕色气体的产生表明木炭与浓硝酸发生了反应
C. 能使液面上木炭迅速燃烧发出亮光的主要气体是氧气
D. 以上实验不能确定使液面上木炭迅速燃烧发出亮光的主要气体一定是NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是l mol金属镁和卤素反应的△H(单位:kJ· mol-1)示意图,反应物和生成物均为常温时的稳定状态,下列选项中不正确的是
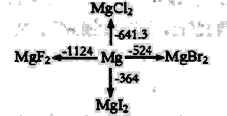
A.由图可知,MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ· mol-1
B.MgI2与Br2反应的△H<0
C.电解MgBr2制Mg是吸热反应
D.化合物的热稳定性顺序:MgI2>MgBr2>MgCl2>MgF2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com