
某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,滴加 氯水,关闭活塞a | A中溶液变为红棕色 |
| Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
| Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是__ _____________________________________________。
_____________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是__________,C中盛放的药品是______________________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式是__________________
______________________________________________________。
(5)由上述实验得出的结论是________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可)______________________________________________________________________
答案 (1)2Br-+Cl2===Br2+2Cl-
(2)吹出单质Br2
(3)吸收尾气 NaOH溶液
(4)H2O2+2Br-+2H+===Br2+2H2O
(5)氧化性:H2O2>Br2>H2SO3
(6)①不干扰,无论热空气是否参加氧化H2SO3,只要观察到产生白色沉淀的同时混合液颜色无明显变化,即能证明Br2氧化了H2SO3
②H2SO3有剩余(H2O2浓度小或Br-与H2O2反应慢等因素都可)
解析 操作Ⅰ的反应为Cl2+2Br-===Br2+2Cl-;操作Ⅱ,吹入热空气的目的是吹出Br2,然后在B中,Br2把H2SO3氧化成H2SO4,H2SO4和BaCl2反应生成BaSO4沉淀;操作Ⅲ,H2O2把Br-氧化成Br2而使溶液变成红棕色。综上所述,氧化性H2O2>Br2>H2SO3。(6)①若是O2氧化H2SO3,则溶液颜色有变化(变为红棕色)。


科目:高中化学 来源: 题型:
钠在空气中燃烧(如下左图所示)生成产物的固体物质中除有淡黄色粉末外,还有黑色固体物质——碳。
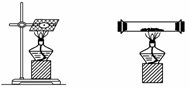
(1)请假设黑色固体物质产生的可能原因是
假设①_________________________________________________________________;
假设②_________________________________________________________________;
假设③_________________________________________________________________。
(2)为确认假设的正误,某同学进行如下推断:由于金属钠与氧的结合能力比碳强,因此黑色碳可能是二氧化碳与金属钠发生置换反应而生成。该同学设计实验如下:
用打孔器钻取一段金属钠,取中间一小块钠放在充满二氧化碳气体的试管(如上右图所示)中加热,观察到钠燃烧发出黄色火焰,并有淡黄色固体和黑色固体生成,生成的淡黄色固体立即变成白色。请回答下列问题:
①用打孔器取金属钠的原因是_____________________________________________;
②产生以上现象的化学反应方程式可能为____________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
家用汽车的调查中发现,新车中气体的质量不符合标准.汽车污染主要来源于汽车配件及材料.它们都会产生大量的有毒有机物气体.其中一种有毒气体的质谱图如下:

则由图可知该分子的相对分子质量是________,若该分子的核磁共振氢谱中有4个吸收峰则有机物的名称为________,其苯环上的一氯代物有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
[选修5——有机化学基础] (15分)
止咳酮(F)具有止咳、祛痰作用。其生产合成路线如下:

(1)已知烃A可以作为一个国家石油化工生产的标志,则A是________(填结构简式) ;由A合成B发生的化学反应类型有 (填字母)。
a.加成反应 b.酯化反应 c.氧化反应 d.消去反应 e.加聚反应
(2)F中含有的官能团名称为
(3)C的核磁共振氢谱中可能出现 组吸收峰;
(4)已知D为氯代烃,C生成E为取代反应,写出C+D→E的化学方程式 。
(5)1mol F与1mol H2加成后生成有机物M,满足下列条件的M的同分异构体有 种。
① 苯的二元取代物
② 1mol M能与含2mol Br2的浓溴水完全发生反应
写出取代基无支链的一种结构______________
(6)目前我国用粮食发酵生产丙酮(CH3COCH3)占较大比重。利用题给相关信息,以淀粉为原料,合成丙酮的流程图如下。请将虚线处过程补充完整。合成过程中无机试剂任选。

查看答案和解析>>
科目:高中化学 来源: 题型:
现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 ( )
A.+2 B.+3 C.+4 D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
 __(D)__+24NaClO3+12H2SO4===
__(D)__+24NaClO3+12H2SO4=== ClO2↑+
ClO2↑+ CO2↑+18H2O+
CO2↑+18H2O+ ________
________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
一未配平的离子方程式为______+XO +6H+===3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为 ( )
+6H+===3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为 ( )
A.1∶1 B.3∶1 C.5∶1 D.7∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下用甲烷可以消除氮氧化物(NOx)的污染。已知:
①CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g);ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g);ΔH=-1160 kJ·mol-1
下列说法不正确的是
A.由反应 ① 可推知:CH4(g)+4NO2(g)= 4NO(g)+CO2(g) +2H2O(l);
DH >-574 kJ/mol
B.反应 ①② 转移的电子数相同
C.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
D.若用标准状况下 4.48LCH4 还原 NO2至 N2,则整个过程中转移的电子总数为1.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径 A>B>D>C B.原子序数 d>c>b>a
C.离子半径 C>D>B>A D.单质的还原性 A>B>D>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com