
【题目】无机化合物可根据其组成和性质进行分类:
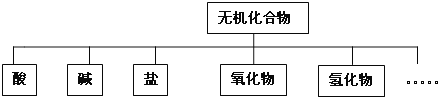
(1)上述所示的物质分类方法名称是 ______ .
(2)①CO2 ②Cu ③FeCl3溶液 ④H2SO4 ⑤氢氧化铁体胶体 ⑥Al2(SO4)3固体 ⑦酒精 ⑧BaSO4固体
属于电解质的是 ______ ;属于非电解质的是 ______ (填序号)。
(3)请写出⑥的电离方程式______________________________________________
(4)下列关于③和⑤的说法正确的是____________。
a.都不稳定,密封静置会产生沉淀
b.⑤能产生丁达尔效应,而③不能
c.加入盐酸都会产生沉淀
(5)按要求写出下列反应的离子方程式:
①锌跟稀硫酸反应_________________________________________________。
②氢氧化钡溶液和稀硫酸反应 ______________________________________。
③MgO滴加稀盐酸_______________________________________________。
【答案】树状分类法 ④⑥⑧ ①⑦ Al2(SO4)3 = 2Al3+ + 3SO42- b Zn+2H+=Zn2++H2↑ Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O MgO+2H+=Mg2++H2O
【解析】
(1)上述所示的物质分类方法名称是树状分类法;
(2)①二氧化碳为酸性氧化物、⑦酒精为一般的有机物,均为非电解质;
②Cu为单质、③FeCl3溶液为混合物、⑤氢氧化铁体胶体为混合物,既不属于电解质也不属于非电解质;
④H2SO4为酸、⑥Al2(SO4)3固体为盐、⑧BaSO4固体为盐,均为电解质;
故电解质为④⑥⑧,非电解质为①⑦;
(3)Al2(SO4)3固体的电离方程式为Al2(SO4)3 = 2Al3+ + 3SO42-;
(4)a. ③为溶液,较稳定,静置后不会产生沉淀,a错误;
b. ⑤为胶体、③为溶液,⑤能产生丁达尔效应,而③不能,b正确;
c. FeCl3溶液加入盐酸无明显现象,c错误;
故答案选b;
(5)①锌跟稀硫酸反应的方程式为Zn+2H+=Zn2++H2↑
②氢氧化钡溶液和稀硫酸反应的方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
③MgO滴加稀盐酸反应的方程式为MgO+2H+=Mg2++H2O
注意②中不要局部约分,③中MgO为难溶物不要拆成离子形式。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】四位同学同时进行反应![]() 的速率测定实验,分别测得反应速率如下:
的速率测定实验,分别测得反应速率如下:
①v(A)=0.15mol/(Ls),②v(B)=0.6mol/(Ls),③v(C)=0.4mol/(Ls),④v(D)=0.45mol/(Ls)。其中反应进行得最快的是( )
A. ①B. ②C. ③D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A. 常温常压下,11.2 L氧气所含的氧原子数为NA
B. 46g NO2和46g N2O4含有的原子数均为3NA
C. lmolO2作为氧化剂得到的电子数一定为4NA
D. 1.8 g D2O含有的质子数和中子数均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸,在化学上有这很重要的用途。某实验员想要用草酸晶体(H2C2O42H2O)配制400mL 0.4mol/L的H2C2O4溶液,请回答下列问题
(1)通过计算,该实验员应该用托盘天平称______ g H2C2O42H2O用来做实验。
(2)请写出该实验的实验步骤
a:计算,b称量,c:_____,d:冷却,e:移液f:洗涤g:________,h:摇匀,i:装液。
(3)在次过程中用到的玻璃仪器除了玻璃棒,烧杯,胶头滴管外,还有_____。
(4)上述配制过程中,下列实验操作对所配制的溶液的物质的量浓度有何影响?(选填“偏高”或“偏低”或“无影响”)。
I.称量粉末时物体和砝码位置放反了(___________)
II.移液过程后没有对玻璃棒和烧杯进行洗涤(_________)
III.定容时俯视刻度线(___________)
IV.摇匀时,容量瓶液面低于刻度线,滴加蒸馏水至刻度线(_________)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验操作中,正确的是( )
|
|
|
|
A.配制硫酸溶液时,将浓硫酸慢慢注入盛有水的容量瓶中进行配制 | B.用托盘天平称量药品时,将药品置于天平左盘 | C.将混合液蒸馏分离时,应使温度计水银球浸没在混合液中 | D.分液时,将上下层液体依次从分液漏斗下口分别流入两个烧杯中 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是
A.所含分子数目相同B.所含氢原子物质的量之比为3∶4
C.质量之比为16∶17D.密度之比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
阴离子 | Cl- CO32— NO3— SO42— SiO32— I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是_____________________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有________;并据此推测原溶液应该呈_______________________________________________性,原因是_________________________________(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为__________________________________________________________。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收利用硫和氮的氧化物是环境保护的重要举措。
(1)已知:2NO(g ) + O2(g)![]() 2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
第一步:2NO(g ) ![]() N2O2(g) △H1 =-a kJmolˉ1 (快反应)
N2O2(g) △H1 =-a kJmolˉ1 (快反应)
第二步:N2O2(g ) + O2(g)![]() 2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
①下列对上述反应过程表述正确的是__________(填标号)。
A.NO比N2O2稳定
B.该化学反应的速率主要由第二步决定
C.N2O2为该反应的中间产物
D.在一定条件下N2O2的浓度为0时反应达到平衡
②该反应逆反应的活化能为_______________。
(2)通过下列反应可从燃煤烟气中回收硫。2CO(g) + 2SO2(g)![]() 2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
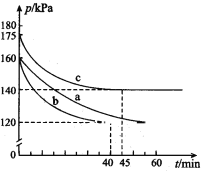
①与实验a相比,实验b改变的实验条件可能是______________________。
②实验b中的平衡转化率a(SO2)=_________。
(3)用NH3消除NO污染的反应原理为: 4NH3 + 6NO![]() 5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:

①曲线c对应NH3与NO 的物质的量之比是_______________。
②曲线a中 NO的起始浓度为4×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________ mg/(m3s)。
(4)双碱法除去SO2是指:用 NaOH 吸收SO2,并用CaO使 NaOH再生。NaOH溶液 ![]() Na2SO3溶液
Na2SO3溶液
①用化学方程式表示NaOH 再生的原理____________________________________ 。
②25℃ 时,将一定量的SO2通入到NaOH溶液中,两者完全反应,得到含Na2SO3、 NaHSO3的混合溶液,且溶液恰好呈中性,则该混合溶液中各离子浓度由大到小的顺序为_____________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com