
【题目】化学对社会发展与进步产生着巨大的贡献。德国化学家哈伯(F.Haber)的重要贡献是( )
A. 实验证实了夸克的存在
B. 发现了黄绿色气体氯气
C. 开发了合成氨的生产工艺
D. 提出了蛋白质分子的螺旋结构模型
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】设用NA表示阿伏加德罗常数的值,其计算近似值为6.02×1023,按要求完成下列填空:
(1)0.5 mol NH3共含有_______________个原子。
(2)6 mol H2O与标准状况下_____________L NH3所含氢原子数相等。
(3)某硫酸钠溶液中含有3.01×1023个Na+,则该溶液中SO42﹣的物质的量是_________________。
(4)标准状况下11.2 L NO和__________________g NO2所含有的氧原子数相等。
(5)8 g某物质含有3.01×1023个分子,该物质的相对分子质量约为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种酸的电离常数如下:K(CH3COOH)=1.8×10-5; K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8。
I.(1)常温下,0.1mol·L-1的下列三种溶液:①CH3COONa溶液 ②Na2CO3溶液 ③NaClO溶液, 其pH由大到小的顺序是________________(填序号);
(2)往NaClO溶液中通入少量CO2的离子反应方程式为___________________________________;
II. 常温下,在25.00 mL 0.1000 mol·L-1Na2CO3溶液中滴加0.1000 mol·L-1盐酸,溶液的pH变化曲线如图所示。
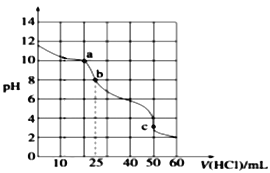
(3)a点溶液中c(CO32-) :c(HCO3-) =______________。
(4)b点溶液中溶质为______________。b点溶液呈碱性的原因为_______________________。
(5)b→c过程中的离子反应方程式为___________________________________________。
III. 现有某碳酸钠和氢氧化钠的混合溶液,为测定其中各成分的浓度,某实验小组设计了如下方案,步骤如下(结合上图回答下列问题):
①量取20.00mL样品溶液于锥形瓶中,加入几滴酚酞;
②用c mol·L-1的标准盐酸溶液滴定至终点;
③重复两次实验,消耗盐酸的体积平均值为V1 mL;
④另取20.00mL样品溶液于锥形瓶中,加入几滴甲基橙;
⑤用c mol·L-1的标准盐酸溶液滴定至终点;
⑥重复两次实验,消耗盐酸的体积平均值为V2 mL;
(6)步骤①中量取样品溶液所用仪器为___________________。
(7)步骤②终点现象为________________________________________________________________。
(8)样品溶液中碳酸钠和氢氧化钠物质的量浓度之比为___________。(用含c、V1、V2的式子表示),若步骤⑥中滴定结束时仰视读数,所得c(Na2CO3)_____(选填“偏大”、“偏小”、“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的某有机物A完全燃烧后,生成0.03mol二氧化碳和0.04mol水,其蒸汽的密度是同温同压条件下氢气密度的30倍。
(1)A的分子式为____________________。
(2)根据其分子组成,A的类别可能为__________或__________(填物质类别)。
(3)A可与金属钠发生置换反应,其H-NMR(氢核磁共振)谱图显示有三组吸收峰,请写出A在铜催化下被氧化的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)最简单的烃分子空间构型为____________________。
(2)衡量一个国家石油化工水平的标志是__________(填名称)的产量。
(3)2,4,6-三硝基甲苯(TNT)的结构简式为____________________。
(4)经催化加氢后生成异戊烷的炔烃结构简式为____________________。
(5)能用高锰酸钾溶液鉴别的是__________(填选项)
a.裂化汽油和直馏汽油 b.苯和甲苯
c.顺-2-丁烯和反-2-丁烯 d.乙醇和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增加的短周期主族元素。W存在4原子核18电子的氢化物分子,X的最外层电子数是电子层数的![]() ,Z与W同主族,X、Y、Z的最外层电子数之和为9。下列说法正确的是
,Z与W同主族,X、Y、Z的最外层电子数之和为9。下列说法正确的是
A. 简单离子半径:W>X>Y>Z
B. 简单氢化物的沸点:Z>W
C. X2W、YZ均为离子化合物
D. W、X、Z三种元素组成的化合物水溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
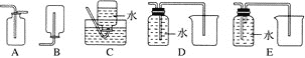
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4、CO2的转化和利用。
(1)在Ni基催化剂的作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni外围价电子中有_________对成对电子。
②CH4、CO2、H2分子中有孤对电子的是_________.
(2)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数如下表。CH4与H2O形成的水合物俗称“可燃冰”。
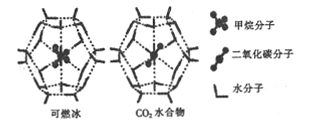
参数 分子 | 分子直径/mm | 分子与H2O的结合能(E) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | y |
①CO2水合物分子间存在的两种作用力是___________.
②为开采深海海底的“可燃冰”,科学家已经证明可用CO2置换CH4。已知上图中笼状结构的空腔直径为xnm,根据上述图表,从物质的结构与性质的角度分析:x_____0.512;y_______16.40。(填“>”“<"或“=”)
③写出CH4的一种等电子体: __________;SiO2与CO2是否互为等电子体?_________(填“是”或“不是”),理由是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com