
【题目】W、X、Y、Z是原子序数依次增加的短周期主族元素。W存在4原子核18电子的氢化物分子,X的最外层电子数是电子层数的![]() ,Z与W同主族,X、Y、Z的最外层电子数之和为9。下列说法正确的是
,Z与W同主族,X、Y、Z的最外层电子数之和为9。下列说法正确的是
A. 简单离子半径:W>X>Y>Z
B. 简单氢化物的沸点:Z>W
C. X2W、YZ均为离子化合物
D. W、X、Z三种元素组成的化合物水溶液显酸性
【答案】C
【解析】分析:X的最外层电子数是电子层数的![]() ,X为Na元素;W存在4原子核18电子的氢化物分子,W的原子序数小于X,W为O元素;Z与W同主族,Z的原子序数大于X,Z为S元素;X、Z的最外层电子数依次为1、6,X、Y、Z的最外层电子数之和为9,Y原子的最外层电子数为2,Y的原子序数介于X与Z之间,Y为Mg元素。
,X为Na元素;W存在4原子核18电子的氢化物分子,W的原子序数小于X,W为O元素;Z与W同主族,Z的原子序数大于X,Z为S元素;X、Z的最外层电子数依次为1、6,X、Y、Z的最外层电子数之和为9,Y原子的最外层电子数为2,Y的原子序数介于X与Z之间,Y为Mg元素。
详解:X的最外层电子数是电子层数的![]() ,X为Na元素;W存在4原子核18电子的氢化物分子,W的原子序数小于X,W为O元素;Z与W同主族,Z的原子序数大于X,Z为S元素;X、Z的最外层电子数依次为1、6,X、Y、Z的最外层电子数之和为9,Y原子的最外层电子数为2,Y的原子序数介于X与Z之间,Y为Mg元素。A项,根据“层多径大,序大径小”,简单离子半径:Z
,X为Na元素;W存在4原子核18电子的氢化物分子,W的原子序数小于X,W为O元素;Z与W同主族,Z的原子序数大于X,Z为S元素;X、Z的最外层电子数依次为1、6,X、Y、Z的最外层电子数之和为9,Y原子的最外层电子数为2,Y的原子序数介于X与Z之间,Y为Mg元素。A项,根据“层多径大,序大径小”,简单离子半径:Z![]() W
W![]() X
X![]() Y,A项错误;B项,W的简单氢化物为H2O,Z的简单氢化物为H2S,H2O分子间存在氢键,H2S分子间不存在氢键,简单氢化物的沸点:W
Y,A项错误;B项,W的简单氢化物为H2O,Z的简单氢化物为H2S,H2O分子间存在氢键,H2S分子间不存在氢键,简单氢化物的沸点:W![]() Z,B项错误;C项,X2W、YZ依次为Na2O、MgS,Na2O、MgS均由活泼金属元素与活泼非金属元素组成,均为离子化合物,C项正确;D项,W、X、Z三种元素组成的化合物有Na2SO4、Na2SO3等,Na2SO4溶液呈中性,Na2SO3溶液呈碱性,D项错误;答案选C。
Z,B项错误;C项,X2W、YZ依次为Na2O、MgS,Na2O、MgS均由活泼金属元素与活泼非金属元素组成,均为离子化合物,C项正确;D项,W、X、Z三种元素组成的化合物有Na2SO4、Na2SO3等,Na2SO4溶液呈中性,Na2SO3溶液呈碱性,D项错误;答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名与化学式对应正确的是
A. 苏打 —— Na2CO3 B. 生石灰 —— Ca(OH)2
C. 胆矾 —— CuSO4 D. 生石膏 —— CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中将盛有甲烷与氯气的混合气体的量筒倒立在盛有饱和食盐水的水槽中,光照使其发生反应,下列说法错误的是( )

A. 通过量筒内壁上出现的油状液滴可以说明生成四种有机产物
B. 氯化氢极易溶于水,导致量筒中液面上升
C. 饱和食盐水能够抑制氯气的溶解
D. 量筒中气体颜色逐渐变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的叙述错误的是
A.SO2可用于杀菌消毒,是一种食品添加剂
B.液氨常用作制冷剂,是因为氨气液化时要吸收大量的热
C.硅单质具有良好的半导体性能,可制成计算机的芯片
D.硫酸铵、碳酸氢铵等铵盐是农业上常用的化肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学对社会发展与进步产生着巨大的贡献。德国化学家哈伯(F.Haber)的重要贡献是( )
A. 实验证实了夸克的存在
B. 发现了黄绿色气体氯气
C. 开发了合成氨的生产工艺
D. 提出了蛋白质分子的螺旋结构模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的转化关系以及现象回答下列问题。
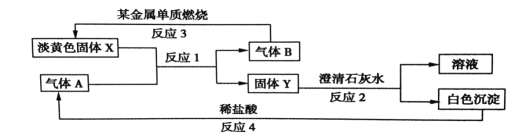
(1)固体 X的化学式是:________________
(2)写出反应1 的化学方程式:____________________________
(3)写出反应2 的离子方程式:________________________________
(4)若15.6gX 和足量的气体 A反应,转移__________mol 电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水;草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是____________,由此可知草酸晶体分解的产物中有_______。

装置B的主要作用是__________________。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置进行实验。


①乙组的实验装置中,依次连接的合理顺序为A→B→____→______→______→______→______→I。装置H反应管中盛有的物质是_________;I中集气瓶收集到的气体主要是_________。
②能证明草酸晶体分解产物中有CO的现象是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为________________________________________。
(2)B的氢化物的结构是____________________________,其空间构型为____________________________________________________。
(3)E核外电子排布式是__________________,E的某种化合物的结构如下图所示。
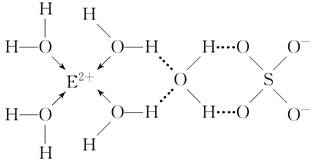
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有______________________。
(4)A与B的气态氢化物的沸点________更高,A与D的气态氢化物的沸点________更高。
(5)A的稳定氧化物中,中心原子的杂化类型为________,空间构型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪90年代初,国际上提出“预防污染”这一新概念,绿色化学是预防污染的基本手段,下列各项属于绿色化学的是
A.减少有毒物B.治理污染点C.处理废弃物D.杜绝污染源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com