
【题目】20世纪90年代初,国际上提出“预防污染”这一新概念,绿色化学是预防污染的基本手段,下列各项属于绿色化学的是
A.减少有毒物B.治理污染点C.处理废弃物D.杜绝污染源
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增加的短周期主族元素。W存在4原子核18电子的氢化物分子,X的最外层电子数是电子层数的![]() ,Z与W同主族,X、Y、Z的最外层电子数之和为9。下列说法正确的是
,Z与W同主族,X、Y、Z的最外层电子数之和为9。下列说法正确的是
A. 简单离子半径:W>X>Y>Z
B. 简单氢化物的沸点:Z>W
C. X2W、YZ均为离子化合物
D. W、X、Z三种元素组成的化合物水溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50Kg的健康人大约含铁2g,这2g铁在人体中不是以单质金属形式存在,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
(1) “服用维生素C,可使食物中三价铁离子还原成二价铁离子。”这句话指出,维生素C在这一反应中做_________剂,具有________性。
(2) 向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体,则其离子方程式为:______________________。
(3) 为了验证Fe3+的性质,某化学兴趣小组设计了如下图所示的一组实验,实验方案设计错误的是_____(填字母)

A. ④和⑤ B. 只有③ C. ③和④ D. ①②③
(4) 已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1L 0.2mol·L-1的FeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是________,此反应的离子方程式:____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中,发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH。其平衡常数(K)和温度(T)的关系如下表:
CO(g)+H2O(g) ΔH。其平衡常数(K)和温度(T)的关系如下表:
T℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
试回答下列问题:
(1)上述反应为____(填“放热”或“吸热”)反应,升高温度,平衡向______ (填“正反应”或“逆反应”) 方向移动。
(2)某温度下,在体积为2L的恒容密闭容器中通入2molCO2(g)和4molH2(B)发生上述应,5min时反应达到平衡,测得CO2(g)的转化率是75%。
①v(H2O)=______mol·L-1·min-l。
②该温度下反应的平衡常数K=______.
(3)生产水煤气的过程如下:
①C(s)+CO2(g) ![]() 2CO(g)ΔH1
2CO(g)ΔH1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2
③反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=________ (用含ΔH1、ΔH2的代数式表示)。
CO(g)+H2O(g) ΔH=________ (用含ΔH1、ΔH2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4、CO2的转化和利用。
(1)在Ni基催化剂的作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni外围价电子中有_________对成对电子。
②CH4、CO2、H2分子中有孤对电子的是_________.
(2)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数如下表。CH4与H2O形成的水合物俗称“可燃冰”。
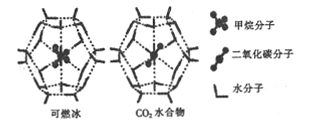
参数 分子 | 分子直径/mm | 分子与H2O的结合能(E) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | y |
①CO2水合物分子间存在的两种作用力是___________.
②为开采深海海底的“可燃冰”,科学家已经证明可用CO2置换CH4。已知上图中笼状结构的空腔直径为xnm,根据上述图表,从物质的结构与性质的角度分析:x_____0.512;y_______16.40。(填“>”“<"或“=”)
③写出CH4的一种等电子体: __________;SiO2与CO2是否互为等电子体?_________(填“是”或“不是”),理由是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印染工业常用亚氯酸钠(NaClO2)漂白织物。用过氧化氢法生产亚氯酸钠的工艺流程如下:
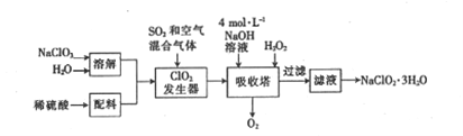
已知:①NaClO2的溶解度随温度的升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②Ksp(FeS)=6.3×10-18;Ksp(CuS)= 6.3×10-36;Ksp(PbS)=2.4×10-28。
(1)发生器中反应的还原剂是_________(填化学式,下同)。吸收塔内ClO2在碱性条件下与H2O2生成NaClO2 的离子方程式为_______
(2)从滤液中得到的NaClO2·3H2O的操作依次是_______、(填字母)、洗染、干燥。
a.蒸馏 b.灼烧 c.冷却结晶 d.蒸发浓缩 e.过滤
(3)亚氯酸钠漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数。
弱酸 | HClO2 | HF | HCN | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,物质的量浓度相同的NaF、NaCN 两种溶液的PH由大到小的顺序为________。
②等体积等物质的量浓度的HClO2与NaOH溶液充分反应后,溶液中各离子浓度由大到小的顺序为_____。
③Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后最先析出的沉淀是______;当最后一种离子沉淀完全时(该离子浓度为10-5 mol·L-l),此时体系中S2-的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成.已知AlN可与NaOH溶液反应放出有刺激性气味的气体.下列叙述正确的是
2AlN+3CO合成.已知AlN可与NaOH溶液反应放出有刺激性气味的气体.下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1molAlN需转移6mol电子
C. AlN中氮元素的化合价为+3
D. AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O═NaAlO2+NH3↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com