
【题目】印染工业常用亚氯酸钠(NaClO2)漂白织物。用过氧化氢法生产亚氯酸钠的工艺流程如下:
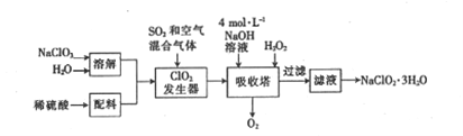
已知:①NaClO2的溶解度随温度的升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②Ksp(FeS)=6.3×10-18;Ksp(CuS)= 6.3×10-36;Ksp(PbS)=2.4×10-28。
(1)发生器中反应的还原剂是_________(填化学式,下同)。吸收塔内ClO2在碱性条件下与H2O2生成NaClO2 的离子方程式为_______
(2)从滤液中得到的NaClO2·3H2O的操作依次是_______、(填字母)、洗染、干燥。
a.蒸馏 b.灼烧 c.冷却结晶 d.蒸发浓缩 e.过滤
(3)亚氯酸钠漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数。
弱酸 | HClO2 | HF | HCN | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,物质的量浓度相同的NaF、NaCN 两种溶液的PH由大到小的顺序为________。
②等体积等物质的量浓度的HClO2与NaOH溶液充分反应后,溶液中各离子浓度由大到小的顺序为_____。
③Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后最先析出的沉淀是______;当最后一种离子沉淀完全时(该离子浓度为10-5 mol·L-l),此时体系中S2-的浓度为________。
【答案】 SO2 ;2OH-+2ClO2+H2O2=2ClO2-+2H2O+O2↑ dce NaCN>NaF c(Na+)>c(ClO2-)>c(OH-)>c(H+) CuS 6.3×10-13mol·L-1
【解析】(1)由流程图可以知道ClO2发生器中目的是产生ClO2, SO2具有还原性,将ClO3-还原为ClO2,自身被氧化为SO42-, SO2作还原剂;吸收塔内的物质为ClO2、NaOH、H2O2,发生氧化还原反应,发生的离子方程式为2OH-+2ClO2+H2O2=2ClO2-+2H2O+O2↑;答案为: SO2 、2OH-+2ClO2+H2O2=2ClO2-+2H2O+O2↑
(2)制备晶体需要经过的操作依次是加热蒸发、冷却结晶、过滤、洗涤等;答案为:dce
(3)电离平衡常数越大,酸性越强,电离平衡常数越小,酸性越弱,根据电离平衡常数可以知道酸性强弱顺序为: HClO2 >HF >H2S>HCN> HS-;①酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,故物质的量浓度相等的各溶液pH关系为:NaCN>NaF②等体积等物质的量浓度的HClO2与NaOH溶液充分反应后,刚好生成NaClO2,是一种强碱弱酸盐,水解显碱性,溶液中各离子浓度由大到小的顺序为c(Na+)>c(ClO2-)>c(OH-)>c(H+);③Ksp(FeS)=6.3×10-18;Ksp(CuS)= 6.3×10-36;Ksp(PbS)=2.4×10-28物质组成类型相同,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀,故首先析出沉淀是CuS;最后析出沉淀是FeS,当最后一种离子沉淀完全时(该离子浓度为![]() ,此时的S2-的浓度为C(S2-)=
,此时的S2-的浓度为C(S2-)=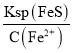 =
=![]() =6.3×10-13mol·L-1
=6.3×10-13mol·L-1
答案为:① >②c(Na+)>c(ClO2-)>c(OH-)>c(H+)③CuS; 6.3×10-13mol·L-1;


科目:高中化学 来源: 题型:
【题目】根据如图所示的转化关系以及现象回答下列问题。
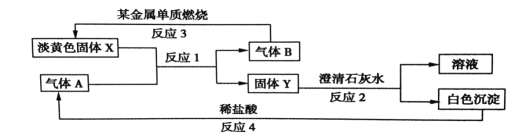
(1)固体 X的化学式是:________________
(2)写出反应1 的化学方程式:____________________________
(3)写出反应2 的离子方程式:________________________________
(4)若15.6gX 和足量的气体 A反应,转移__________mol 电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
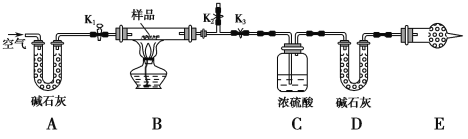
(1) 实验步骤:
① 按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是____________________。
② 称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是___________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为___________________________、______________________________。
⑤ 打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2) 关于该实验方案,请回答下列问题。
① E处干燥管中盛放的药品是________,其作用是______________________________________,如果实验中没有该装置,则可能导致测量结果NaHCO3的质量分数________(填“偏大”“偏小”或“无影响”)。
② 若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为__________________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】9.03×1023个CH4中,含____mol碳原子,____mol氢原子,____mol质子,____mol电子。与____个NH3含有相同数目的氢原子。标准状况下CH4所占的体积为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪90年代初,国际上提出“预防污染”这一新概念,绿色化学是预防污染的基本手段,下列各项属于绿色化学的是
A.减少有毒物B.治理污染点C.处理废弃物D.杜绝污染源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是( )
A.K2CO3和K2O都属于盐
B.H2SO4和NaHSO4都属于酸
C.KOH和NH3H2O都属于碱
D.Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。
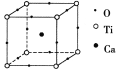
(1)在该物质的晶体结构中,每个钛离子周围与它最近且距离相等的钛离子、钙离子各有__________个、__________个。
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构如图中正方体边长(钛原子之间的距离)为d nm(1 nm=1×10-9 m),则该晶体的密度为__________g/cm3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法正确的是
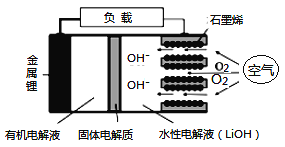
A. Li+穿过固体电解质向正极移动而得到LiOH溶液
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
D. 放电时,负极反应式:Li-e-+OH-=LiOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com