
【题目】如右图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。
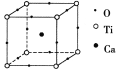
(1)在该物质的晶体结构中,每个钛离子周围与它最近且距离相等的钛离子、钙离子各有__________个、__________个。
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构如图中正方体边长(钛原子之间的距离)为d nm(1 nm=1×10-9 m),则该晶体的密度为__________g/cm3(阿伏加德罗常数用NA表示)。
科目:高中化学 来源: 题型:
【题目】(1)阅读、分析下列两个材料:
材料一
物质 | 熔点/℃ | 沸点/℃ | 密度/g/cm3 | 溶解性 |
乙二醇 | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
材料二

回答下列问题(填序号):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好用 ;
②将乙二醇和丙三醇相互分离的最佳方法是___________。
(2)阅读材料三
在溶解性方面,Br2(溴)与I2很相似,其稀的水溶液显黄色。在实验室里从溴水(Br2的水溶液)中提取Br2和提取I2的方法相似。
回答下列问题:
①常用的提取方法是____________,化学试剂是 ,最主要的仪器是 。
②若观察发现提取Br2以后的水还有颜色,解决该问题的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
P4(白磷,s)+5O2(g)═P4O10(s)△H=﹣2983.2kJ/mol
P(红磷,s)+ ![]() O2(g)═
O2(g)═ ![]() P4O10(s)△H=﹣738.5kJ/mol
P4O10(s)△H=﹣738.5kJ/mol
试写出白磷转化为红磷的热化学方程式;白磷的稳定性比红磷(填“高”或“低”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJmol﹣1、E2=y kJmol﹣1 , 下列有关说法中正确的是( ) 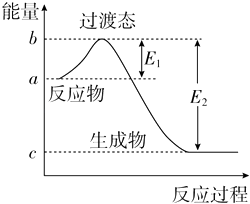
A.若在反应体系中加入催化剂,E1不变
B.若在反应体系中加入催化剂,△H减小
C.反应的活化能等于y kJmol﹣1
D.1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=(x﹣y) kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图甲所示为二维平面晶体示意图,化学式表示为AX3的是________。
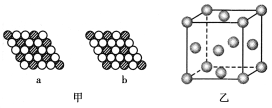
(2)图乙为一个金属铜的晶胞,请完成以下各题:
①该晶胞“实际”拥有的铜原子数是________个;
②该晶胞称为________(填序号);
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数为________(用aρ表示)。
(3)《X射线金相学》中记载关于铜与金可形成两种有序的金属互化物,其结构如下图所示。下列有关说法正确的是________。
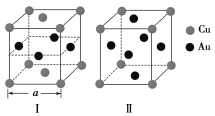
A.图Ⅰ、Ⅱ中物质的化学式相同
B.图Ⅱ中物质的化学式为CuAu3
C.图Ⅱ中与每个铜原子紧邻的铜原子有3个
D.设图Ⅰ中晶胞的边长为a cm,则图Ⅰ中合金的密度为![]() g·cm-3
g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某蛋白质分子的结构示意图,图中α链由21个氨基酸组成,β链由19个氨基酸组成,图中“-S-S-”是在蛋白质加工过程中由两个“-SH”脱下2个H形成的。下列有关叙述中,错误的是( )
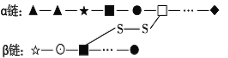
A.蛋白质多样性的原因包括氨基酸的排列顺序不同
B.该蛋白质含有40种氨基酸
C.该蛋白质分子中至少含有42个O原子
D.形成该蛋白质分子时相对分子质量减少了686
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1)配平离子方程式:MnO4﹣+HSO3﹣+H+﹣﹣Mn2++SO42﹣+H2O
(2)用KMnO4进行滴定时,KMnO4溶液应装在中,判断滴定终点的现象是 .
(3)下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定前滴定管尖嘴部分有气泡
D.观察读数时,滴定前仰视,滴定后俯视
(4)根据下表中测定的实验数据,计算KMnO4溶液体积的平均值为mL;NaHSO3溶液的物质的量浓度为mol/L(数据精确到0.1)
实验编号 | 待测NaHSO3溶液的体积/mL | KMnO4溶液的体积/mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com