
【题目】根据如图所示的转化关系以及现象回答下列问题。
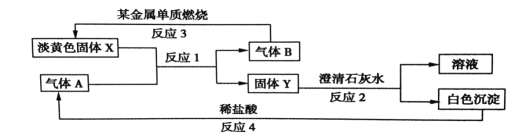
(1)固体 X的化学式是:________________
(2)写出反应1 的化学方程式:____________________________
(3)写出反应2 的离子方程式:________________________________
(4)若15.6gX 和足量的气体 A反应,转移__________mol 电子。
【答案】(1)过氧化钠 Na2CO3(2)2Na2O2+2CO2=2Na2CO3+O2(3)Na2CO3+Ca(OH)2= CaCO3↓+2NaOH(4)0.2
【解析】
试题(1)Na2CO3能与水及二氧化碳发生反应,所以与它反应的气体A是二氧化碳。(2)反应产生碳酸钠和氧气。固体Y是碳酸钠,气体B是氧气。钠在氧气中燃烧得到过氧化钠淡黄色固体。反应的方程式:2Na2O2+2CO2=2Na2CO3+O2。(3)二氧化碳与氢氧化钙发生反应产生碳酸钙沉淀和水。反应的方程式为:Na2CO3+Ca(OH)2= CaCO3↓+2NaOH。碳酸钙与盐酸发生反应生成氯化钙、水和二氧化碳。(4)Na2O2化学式的式量是78,15.6g过氧化钠的物质的量是0.2mol.根据化学方程式:2Na2O2+2H2O=4NaOH+O2↑可知若有2mol过氧化钠反应,转移电子2mol.现在有0.2mol发生反应,所以转移电子0.2mol.


科目:高中化学 来源: 题型:
【题目】用石墨作电极电解下列溶液一段时间后,溶液的pH均增大,再加入一定量括号内的物质,都能使溶液恢复到原来的成分和浓度的是( )
A.AgNO3(AgNO3)B.NaOH (H2O)
C.KCl (KCl)D.CuSO4(CuSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的现象描述与离子方程式都正确的是
A. 锌片插入硝酸银溶液中,有银析出: ![]()
B. 氢氧化钡溶液与稀硫酸反应,有白色沉淀生成: ![]()
C. 氢氧化铜加到盐酸中, 无明显现象: ![]()
D. 碳酸钡中加入稀盐酸,固体溶解,生成无色无味气体: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增加的短周期主族元素。W存在4原子核18电子的氢化物分子,X的最外层电子数是电子层数的![]() ,Z与W同主族,X、Y、Z的最外层电子数之和为9。下列说法正确的是
,Z与W同主族,X、Y、Z的最外层电子数之和为9。下列说法正确的是
A. 简单离子半径:W>X>Y>Z
B. 简单氢化物的沸点:Z>W
C. X2W、YZ均为离子化合物
D. W、X、Z三种元素组成的化合物水溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L苯所含的碳碳双键数为3NA
B.常温常压下,1mol乙烯所含电子数为12NA
C.1mol金属钠在足量乙醇中完全反应转移的电子数为NA
D.在1L 1mol·L-1的乙酸溶液中含乙酸分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了能观察到丁达尔效应,一中鼹鼠科学社的同学在实验室制备Fe(OH)3胶体。
(1)胶体与其他分散系的本质区别是:__。
(2)制备时,将_逐滴滴加至_中,待液体呈_后,停止加热;反应方程式为__。
(3)有一种橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,这叫__现象,证明Sb2S3胶粒带__电荷。
(4)如何设计实验验证制得的氢氧化铁是胶体:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列气态分子BCl3、CCl4、H2O和BeCl2中,其键角由大到小的顺序为________。
(2)硫化氢(H2S)分子的空间构型为________;二氧化碳(CO2)分子的空间构型为________;甲烷(CH4)分子的空间构型为________。
(3)由于氨水和次氯酸盐溶液在弱碱性介质中反应可生成氯胺(H2NCl),分子结构类似于NH3,H2NCl分子的空间构型为________,电子式为________,H2NCl中氯的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印染工业常用亚氯酸钠(NaClO2)漂白织物。用过氧化氢法生产亚氯酸钠的工艺流程如下:
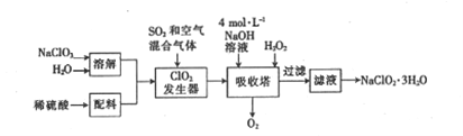
已知:①NaClO2的溶解度随温度的升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②Ksp(FeS)=6.3×10-18;Ksp(CuS)= 6.3×10-36;Ksp(PbS)=2.4×10-28。
(1)发生器中反应的还原剂是_________(填化学式,下同)。吸收塔内ClO2在碱性条件下与H2O2生成NaClO2 的离子方程式为_______
(2)从滤液中得到的NaClO2·3H2O的操作依次是_______、(填字母)、洗染、干燥。
a.蒸馏 b.灼烧 c.冷却结晶 d.蒸发浓缩 e.过滤
(3)亚氯酸钠漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数。
弱酸 | HClO2 | HF | HCN | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,物质的量浓度相同的NaF、NaCN 两种溶液的PH由大到小的顺序为________。
②等体积等物质的量浓度的HClO2与NaOH溶液充分反应后,溶液中各离子浓度由大到小的顺序为_____。
③Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后最先析出的沉淀是______;当最后一种离子沉淀完全时(该离子浓度为10-5 mol·L-l),此时体系中S2-的浓度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com