
【题目】(1)下列气态分子BCl3、CCl4、H2O和BeCl2中,其键角由大到小的顺序为________。
(2)硫化氢(H2S)分子的空间构型为________;二氧化碳(CO2)分子的空间构型为________;甲烷(CH4)分子的空间构型为________。
(3)由于氨水和次氯酸盐溶液在弱碱性介质中反应可生成氯胺(H2NCl),分子结构类似于NH3,H2NCl分子的空间构型为________,电子式为________,H2NCl中氯的化合价为________。
科目:高中化学 来源: 题型:
【题目】在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
A.正极附近的SO42―离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的转化关系以及现象回答下列问题。
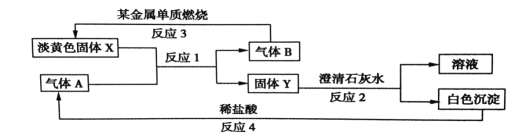
(1)固体 X的化学式是:________________
(2)写出反应1 的化学方程式:____________________________
(3)写出反应2 的离子方程式:________________________________
(4)若15.6gX 和足量的气体 A反应,转移__________mol 电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)无水CoCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水CoCl2,故常在实验室中用作吸湿剂和空气湿度指示剂。

现有65g无水CoCl2,吸水后变成CoCl2·xH2O 119g。
(1)水合物中x=______;
(2)若该化合物中Co2+的配位数为6,而且经测定得知内界和外界占有Cl-的个数比为1:1,则其化学式可表示为:______
(Ⅱ)在极性分子中,正电荷中心同负电荷中心间的距离称为偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
(3)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上。已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0。
①试在方框中画出两种异构体的构型图:_________;___________________

②该化合物的两种异构体在水中溶解度较大的是___________________(填“棕黄色者”或“淡黄色者”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为________________________________________。
(2)B的氢化物的结构是____________________________,其空间构型为____________________________________________________。
(3)E核外电子排布式是__________________,E的某种化合物的结构如下图所示。
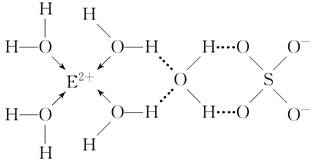
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有______________________。
(4)A与B的气态氢化物的沸点________更高,A与D的气态氢化物的沸点________更高。
(5)A的稳定氧化物中,中心原子的杂化类型为________,空间构型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。某小组制备亚硝酸钠的实验装置如图所示(部分夹持装置已略去)。
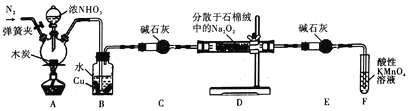
已知:
①2NO+Na2O2=2NaNO2、2NaNO2+O2=2NaNO3
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2都能与MnO4-反应生成NO3-和Mn2+
回答下列问题:
(1)反应前需先打开弹簧夹,通入氮气排尽装置中的空气,原因是__________________。
(2)装置A中反应的化学方程式为_________________;装置B中的实验现象为_____________,铜片逐渐溶解并有气泡产生。
(3)若省略装置C,则装置D中的固体产物除NaNO2、NaOH外,还有__________、___________(填化学式)。检验产物中含有NaNO2的方法是:取少量样品于试管中,_____________________,则说明产物中含有NaNO2。
(4)装置E的作用是___________________________。
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O。根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,除样品外必须选用的物质有_________(填标号)。
a.白酒 b.碘化钾、淀粉溶液 c.白醋 d.白糖
(6)充分反应后,该小组设计实验检测产物中NaNO2的含量。称取装置D中固体2.3000g,完全溶解配制成溶液l00mL,取出25.00mL溶液用0.100mol·L-1酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),三次滴定平均消耗KMnO4溶液30.00mL,则样品中NaNO2的质量分数为_______________。(已知:NaNO2的摩尔质量为69g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
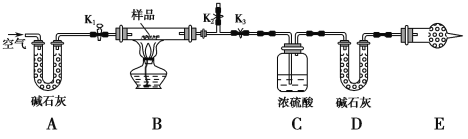
(1) 实验步骤:
① 按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是____________________。
② 称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是___________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为___________________________、______________________________。
⑤ 打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2) 关于该实验方案,请回答下列问题。
① E处干燥管中盛放的药品是________,其作用是______________________________________,如果实验中没有该装置,则可能导致测量结果NaHCO3的质量分数________(填“偏大”“偏小”或“无影响”)。
② 若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为__________________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】9.03×1023个CH4中,含____mol碳原子,____mol氢原子,____mol质子,____mol电子。与____个NH3含有相同数目的氢原子。标准状况下CH4所占的体积为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法正确的是
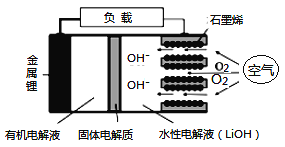
A. Li+穿过固体电解质向正极移动而得到LiOH溶液
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
D. 放电时,负极反应式:Li-e-+OH-=LiOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com