
| A. | 3p2表示3p能级有两个轨道 | B. | 原子晶体中可能存在离子键 | ||
| C. | 分子晶体中一定存在共价键 | D. | sp2杂化轨道模型为 |
分析 A.3p2表示3p能级有两个电子;
B.原子晶体中只含有共价键;
C.单原子分子中没有共价键;
D.sp2杂化轨道是一个s轨道和2个p轨道杂化形成的.
解答 解:A.3p2表示3p能级有两个电子,而不是两个轨道,p轨道含有三个轨道,故A错误;
B.原子晶体中只含有共价键,含有离子键的晶体为离子晶体,故B错误;
C.单原子分子中没有共价键,如稀有气体,所以分子晶体中不一定存在共价键,故C错误;
D.sp2杂化轨道是一个s轨道和2个p轨道杂化形成的,sp2杂化轨道保护三个轨道,其模型为 ,故D正确.
,故D正确.
故选D.
点评 本题考查的知识点较综合,题目涉及电子排布式、晶体和共价键、杂化轨道理论及其应用,题目的难点是杂化轨道理论的有关知识,注意归纳整理和理解,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙难溶于水,所以碳酸钙属于非电解质 | |
| B. | 溶于水能电离出氢离子的化合物都是酸 | |
| C. | 稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则使金属钝化 | |
| D. | 将铝箔在酒精灯上加热至熔化,熔化的铝并不滴下,这是因为铝表面的氧化膜保护了铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
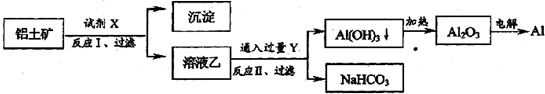
| A. | 试剂X为稀硫酸 | |
| B. | 反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| C. | 结合质子( H+)的能力由强到弱的顺序是:OH->HCO3->AlO2- | |
| D. | Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,12C碳-12原子所含有的碳原子数目的物质的量为1摩 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦ | B. | ②⑤⑦ | C. | ③④⑥ | D. | 全有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2溶液和Na2SO4溶液 | B. | 金属钠和MgCl2溶液 | ||
| C. | 金属铝和NaOH溶液 | D. | FeCl3溶液和Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23gNO2和23gN2O4所含原子数目均为1.5NA | |
| B. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA | |
| C. | 在常温常压下11.2L氯气所含的原子数目为NA | |
| D. | 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com