
分析 (1)溶液中离子的浓度=电解质的浓度×一个分子中含有的离子数目;将溶液中的Ba2+恰好完全沉淀,则n(H2SO4)=n(BaSO4)=n(BaCl2),再根V=$\frac{n}{c}$计算需要硫酸的体积;
(2)根据V=nVm=$\frac{m}{M}$Vm可知:相同条件下,相等质量的气体,其摩尔质量越小占有的体积越大;
(3)实验室利用二氧化锰做氧化剂和还原剂浓盐酸加热反应生成二氧化锰、氯气和水;氧化剂是二氧化锰,还原剂是盐酸,两者物质的量之比为:1:2;产生标准状况下33.6LCl2即1.5mol,转移电子为3mol.
解答 解:(1)100ml0.25mol.L-1BaCl2溶液中,Cl-的物质的量浓度为c(Cl-)=2c(BaCl2)=2×0.25mol/L=0.5mol/L;,将溶液中的Ba2+恰好完全沉淀,则n(H2SO4)=n(BaSO4)=n(BaCl2)=0.1L×0.25mol/L=0.025mol,需要硫酸的体积为$\frac{0.025mol}{1mol/L}$=0.025L=25mL,故答案为:0.5mol/L;25;
(2)根据V=nVm=$\frac{m}{M}$Vm可知:相同条件下,相等质量的气体,其摩尔质量越小占有的体积越大,由于摩尔质量:SO2>CO2>O2>CH4,故甲烷的体积最大,
故答案为:②;
(3)实验室利用二氧化锰做氧化剂和还原剂浓盐酸加热反应生成二氧化锰、氯气和水,反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氧化剂是二氧化锰,还原剂是盐酸,两者物质的量之比为:1:2;产生标准状况下33.6LCl2即1.5mol,转移电子为3mol,故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;MnO2; 1:2; 3mol.
点评 本题考查物质的量有关计算、氧化物的分类等,比较基础,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 2,2-甲基-3-乙基丁烷 | B. | 2-甲基-3-乙基戊烷 | ||
| C. | 3-甲基-2-乙基戊烷 | D. | 2,3,4-3甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水吸收SO2:NH3•H2O+SO2═NH4++HSO3- | |
| B. | 铁和稀硝酸反应后,溶液pH=2 Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 用石灰水处理含有Mg2+和HCO3-的硬水,发生反应的离子方程式为Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O | |
| D. | 向银氨溶液中加入盐酸[Ag(NH3)2]++OH-+3H+═Ag++2NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 左盘下沉 | B. | 右盘下沉 | C. | 仍保持平衡 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
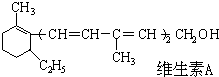
| A. | 维生素A的一个分子中有五个双键 | |
| B. | 维生素A的一个分子中有30个氢原子 | |
| C. | 维生素A能使溴水褪色,能被酸性KMnO4氧化 | |
| D. | 维生素A是一种烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol/L的NaOH溶液中加入等体积的0.1mol/L的HCl溶液 | |
| B. | 向0.1mol/L的NaOH溶液中加入等体积的0.1mol/L的CH3COOH溶液 | |
| C. | 向0.1mol/L的Ba(OH)2溶液中加入等体积的0.1mol/L的H2SO4溶液 | |
| D. | 向0.1mol/L的NH3•H2O溶液中加入等体积的0.1mol/L的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>c(OH-)>cCH3COO-) | |
| B. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com