
| A. | 18.6g | B. | 20g | C. | 19.4g | D. | 24g |
分析 根据n=$\frac{V}{{V}_{m}}$计算出反应生成NO的物质的量,然后根据硝酸与金属反应生成一氧化氮中化合价变化计算出转移电子的物质的量;
金属在反应中的转化关系为:M→Mn+→M(OH)n,再结合电子守恒可知,金属失去电子的物质的量等于硝酸中N原子得到电子的物质的量,也等于生成沉淀时结合OH-的物质的量,据此可以计算出最多生成沉淀的质量=金属质量+净增OH-的质量,由于沉淀中没有氢氧化铝,所以生成沉淀的质量小于该沉淀的最大值.
解答 解:硝酸与金属反应生成一氧化氮:HNO3→NO,化合价降低3价,得到3e-电子,标况下4.48LNO的物质的量为:n(NO)=$\frac{4.48L}{22.4L/mol}$=0.2mol,得到电子的物质的量为:n(e-)=3e-×0.2mol=0.6mol,
根据金属的转化关系:M→Mn+→M(OH)n和电子守恒可知,金属失去电子的物质的量等于硝酸中N原子得到电子的物质的量,也等于生成沉淀时结合OH-的物质的量,即:n(OH-)=n(e-)=0.6mol,
则最多生成沉淀的质量为:金属质量+净增OH-的质量=9.2g+0.6mol×17g/mol=19.4g,
由于沉淀中没有氢氧化铝,所以生成沉淀的质量小于19.4g,
故选A.
点评 本题考查混合物的有关计算,题目难度中等,解题关键是正确判断金属提供的电子的物质的量与氢氧根的物质的量之间的关系,要求学生明确守恒思想运用方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
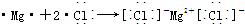 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列叙述错误的是( )
,下列叙述错误的是( )| A. | 反应①和②互为可逆反应 | |
| B. | 反应①中I2既作氧化剂又作还原剂 | |
| C. | 反应②中IO3-作氧化剂 | |
| D. | 检验加碘盐中的KIO3可用淀粉KI溶液和食醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋壳浸泡在盐酸中产生气泡:CO32-+2H+═CO2↑+H2O | |
| B. | 将氨气通入硫酸溶液中:NH3+H+═NH4+ | |
| C. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 向碳酸氢铵溶液中加入足量的NaOH溶液:NH4++OH-═NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

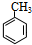 +Br2$\stackrel{光照}{→}$
+Br2$\stackrel{光照}{→}$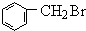 +HBr
+HBr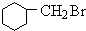 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$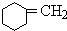 +NaBr+H2O
+NaBr+H2O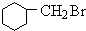 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$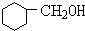 +NaBr.
+NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-中含有9个质子,9个电子 | |
| B. | Na的原子半径比Cl的大,但Na+的半径比Cl-的小 | |
| C. | 与某非金属反应时甲原子失电子数目比乙的多,说明甲的金属性比乙强 | |
| D. | Na2O 和Na2O2中所含的化学键类型完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com