
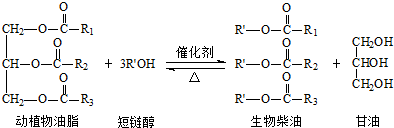
| A. | 生物柴油是不同酯组成的混合物 | B. | 动植物油脂是高分子化合物 | ||
| C. | “地沟油”可用于制备生物柴油 | D. | 生物柴油由可再生资源制得 |
分析 A.生物柴油通常是指以动植物油脂为原料生产的、以脂肪酸甲酯为主要成份的液体燃料;
B.相对分子质量在10000以上的有机化合物为高分子化合物;
C.“地沟油”中含有动植物油脂,动植物油脂与醇反应可制备生物柴油;
D.生物柴油其原料取自可再生的动植物资源.
解答 解:A.生物柴油通常是指以动植物油脂为原料生产的、以不同脂肪酸甲酯组成的混合物,故A正确;
B.动植物油脂是高分子化合物相对分子质量小于10000,不是高分子化合物,故B错误;
C.“地沟油”中含有动植物油脂,动植物油脂与醇反应可制备生物柴油,故C正确;
D.“地沟油”中含有动植物油脂,动植物油脂与醇反应可制备生物柴油,故D正确生物柴油由可再生资源制得,故D正确;故选B.
点评 本题主要考查了油脂的性质与用途,题目难度不大,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
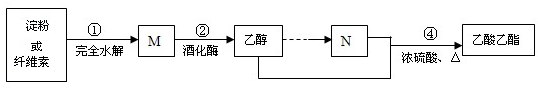
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 性质或结构信息 |
| B | 原子最外层电子数是电子层数的3倍. |
| C | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍. |
| D | 单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里. |
| E | 最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子. |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

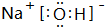 ,其晶体类型为离子晶体.
,其晶体类型为离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2A+3B=3C | B. | 3A+2B=2C | C. | 2A+2B=3C | D. | 2A+3B=2C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl 和 NaOH 反应的中和热△H=-57.3 kJ•mol-1,则 H2SO4和 Ca(OH)2 反应的中和热△H=2×(-57.3)kJ•mol -1 | |
| D. | 在 101 kPa 时,2gH2完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com