
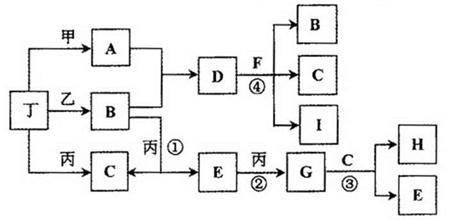
 乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。
乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。 NCl3+3H2↑ NCl3+3H2O+6NaClO2=6ClO2+3NaCl+3NaOH+3NH3 (6)100ml
NCl3+3H2↑ NCl3+3H2O+6NaClO2=6ClO2+3NaCl+3NaOH+3NH3 (6)100ml N2+3H2,可知,加入B(NH3)平衡向正反应方向移动,且达到平衡是B的转化率降低。(4)根据上述可知,A、B、D分别为HCl、NH3、NH4Cl当三者物质的量浓度相同的水溶液时,NH4Cl促进水的电离,HCl、NH3抑制水的电离,且HCl为强电解质,完全电离,抑制水的电离能力更强,故水的电离程度大小为NH4C>NH3>HCl,故答案应为)D>B>A。(5)根据题目叙述,推断可知,反应方程式为2HCl+NH4Cl
N2+3H2,可知,加入B(NH3)平衡向正反应方向移动,且达到平衡是B的转化率降低。(4)根据上述可知,A、B、D分别为HCl、NH3、NH4Cl当三者物质的量浓度相同的水溶液时,NH4Cl促进水的电离,HCl、NH3抑制水的电离,且HCl为强电解质,完全电离,抑制水的电离能力更强,故水的电离程度大小为NH4C>NH3>HCl,故答案应为)D>B>A。(5)根据题目叙述,推断可知,反应方程式为2HCl+NH4Cl NCl3+3H2↑NCl3+3H2O+6NaClO2=6ClO2+3NaCl+3NaOH+3NH3。(6)Fe、FeO、Fe3O4的混合物二等分,其中一份加入1mol/L的A溶液100 mL,恰好使混合物全部溶解所得溶液中加入KSCN溶液,溶液不变红,证明所得的溶液中不含有三价铁离子,有因为A为HCl,故溶质只为FeCl2。物质的量=(1mol/L×0.1L)/2=0.05mol。另一份混合物加入1 mol/ L 的H(HNO3)溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也不变红,证明不含三价铁离子,溶质只为Fe(NO3)2根据质量守恒,Fe元素物质的量不变,故n(FeCl2)=n(Fe(NO3)2)=0.05mol。故加入HNO3的体积为100ml。
NCl3+3H2↑NCl3+3H2O+6NaClO2=6ClO2+3NaCl+3NaOH+3NH3。(6)Fe、FeO、Fe3O4的混合物二等分,其中一份加入1mol/L的A溶液100 mL,恰好使混合物全部溶解所得溶液中加入KSCN溶液,溶液不变红,证明所得的溶液中不含有三价铁离子,有因为A为HCl,故溶质只为FeCl2。物质的量=(1mol/L×0.1L)/2=0.05mol。另一份混合物加入1 mol/ L 的H(HNO3)溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也不变红,证明不含三价铁离子,溶质只为Fe(NO3)2根据质量守恒,Fe元素物质的量不变,故n(FeCl2)=n(Fe(NO3)2)=0.05mol。故加入HNO3的体积为100ml。

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

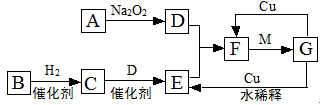
 2Fe2O3+8SO2
2Fe2O3+8SO2查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
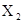 共有3种,其相对分子质量依次为158、160、162,其三种分子的物质的量之比是7:10:7则下列结论正确的是 ( )
共有3种,其相对分子质量依次为158、160、162,其三种分子的物质的量之比是7:10:7则下列结论正确的是 ( )| A.X有三种同位素 |
| B.其中一种同位素的原子质量数为81 |
| C.质量数为79的同位素,其原子质量分数为50% |
D.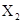 的平均相对分子质量为159 的平均相对分子质量为159 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题

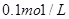 的NaOH溶液滴定
的NaOH溶液滴定 mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是 点;a点溶液中离子浓度的大小顺序为 ;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。
mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是 点;a点溶液中离子浓度的大小顺序为 ;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com