
地球的海水总量约有1.4×1018 t,是人类最大的资源库
(1)如图利用海水得到淡水的方法为________。

(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图:

a是电源的________极;I口排出的是________(填“淡水”或“浓水”)。
(3)海水淡化后的浓水中含大量盐分,排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产。
①电解前需要把浓水精制,加入试剂的顺序为___________________________________;
②用离子交换膜电解槽电解食盐水的化学方程式为
_________________________________________________________________________________________________________________________________。
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在,每吨海水只含3.3 mg铀,海水总量极大,铀总量相当巨大。不少国家正在探索海水提铀的方法。现在,已经研制成功了一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素。其反应原理为________(树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为_______________________________________________________________________________________________________________________________。
(1)蒸馏法
(2)负 淡水
(3)①NaOH、BaCl2(NaOH和BaCl2位置可互换)、Na2CO3、盐酸
②2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(4)4HR+U4+=UR4+4H+ UR4+4H+=4HR+U4+
【解析】(1)海水经过蒸发和冷凝得到淡水,原理与蒸馏相同,故方法可归类为蒸馏法。(2)从阴极接电源负极,阳极接电源正极以及图中阴、阳离子移动方向可知a是电源的负极;利用电场作用,使海水中阴、阳离子分别向阳、阴极定向移动,但在阳膜和阴膜的离子选择性透过作用下,使有的间隔内离子浓度变大(如②间隔),有的间隔内离子浓度变小(如①间隔),故得出Ⅰ口排出的是淡水。(3)浓水需精制后才能电解,精制时一般先加烧碱除去Mg2+、Fe3+等,再加氯化钡除去SO42-,再加碳酸钠除去Ca2+和过量的Ba2+,过滤出沉淀后加盐酸调节pH。(4)根据离子交换树脂交换溶液中阳离子的离子方程式,迁移到交换铀离子的离子方程式,一定要注意铀离子带4个单位的正电荷,用酸处理交换后的树脂又得到铀离子和树脂。


科目:高中化学 来源:2014年高二化学苏教版选修2 3.2合成洗涤剂的生产练习卷(解析版) 题型:选择题
下列物质中,分子的一端亲水,另一端亲油的是( )。
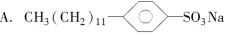
B.CH3CH2CH3
C.CCl4
D.CH3(CH2)4COOC2H5
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 2.2氯碱生产练习卷(解析版) 题型:选择题
下列关于离子交换膜电解槽的叙述,错误的是( )。
A.精制的饱和食盐水进入阳极室
B.纯水(加少量NaOH)进入阴极室
C.阴极产物为NaOH和氢气
D.电解槽的阳极用金属铁网制成
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 1专题综合检测练习卷(解析版) 题型:选择题
水的污染主要来自( )。
①天然水与空气、岩石和土壤长期接触
②工业生产中废气、废液、废渣的排放
③水生动物的繁殖
④城市生活污水的大量排放
⑤农业生产中农药、化肥施用不当
A.④⑤ B.②④⑤ C.①②③ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 1专题综合检测练习卷(解析版) 题型:选择题
下列方法适宜于软化永久硬水的是( )。
A.离子交换法 B.长时间加热
C.加入Na2SO4 D.加入AgNO3
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 1.3海水淡化练习卷(解析版) 题型:选择题
下列关于海水知识不正确的是( )。
A.海水资源的利用包括海水水资源利用和化学资源利用
B.海水既苦又涩,不能直接利用
C.海水中某些金属元素总储量很大,但富集程度却很低
D.海水淡化应同化工生产结合,同能源技术结合
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 1.1水的净化与污水处理练习卷(解析版) 题型:填空题
请你参与下列问题的探究:
(1)三峡工程二期已经开始蓄水,为防止三峡库区水被污染,应该采取的措施是________(填序号)。
①清理蓄水库底废弃物
②防止船舶污染
③整治相关河流污染
④治理库区和上游工业污染
(2)载人飞船须建立水的循环体系,以保证宇航员的生活用水并减少飞船的携水量。请将图中各项用箭头连接成水的循环系统(注:氢氧燃料电池反应产生电能,同时生成水)。
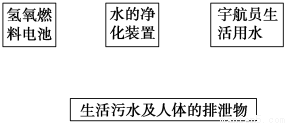
(3)日常生活中我们要科学合理地节约用水,有一个水龙头,每秒漏水2滴,则一天漏水________g(平均每20滴为1 mL,水的密度为1 g·mL-1)。若每个人每日补充水2.5 L,则这些水可以给一个人补充________天水。(计算结果精确到0.1)
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 8化学平衡移动练习卷(解析版) 题型:选择题
对处于平衡状态的反应:2A(g)+B(g) 2C(g)(已知反应为放热反应),下列叙述正确的是( )
2C(g)(已知反应为放热反应),下列叙述正确的是( )
A.增大压强,v(正)增大,v(逆)减小
B.升高温度,v(正)减小,v(逆)增大
C.增大A浓度的瞬间,v(正)增大,v(逆)不变
D.增大A浓度的瞬间,v(正)增大而v(逆)减小
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 4化学反应热的计算练习卷(解析版) 题型:填空题
把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g) CO2(g) ΔH1<0①
CO2(g) ΔH1<0①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g) CO(g)+H2(g) ΔH2>0②
CO(g)+H2(g) ΔH2>0②
再燃烧水煤气:
2CO(g)+O2(g) 2CO2(g) ΔH3<0③
2CO2(g) ΔH3<0③
2H2(g)+O2(g) 2H2O(g) ΔH4<0④
2H2O(g) ΔH4<0④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上 (填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是 。
(3)已知:①C(s)+O2(g) CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g) TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s) TiCl4(s)+2CO(g)的ΔH= 。
TiCl4(s)+2CO(g)的ΔH= 。
(4)已知下列各组热化学方程式
①Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) ΔH3=+640 kJ·mol-1
3FeO(s)+CO2(g) ΔH3=+640 kJ·mol-1
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式 ______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com