
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
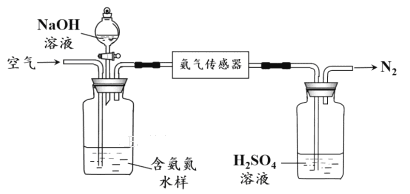
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为 mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。

① 已知A、B两极生成CO2和N2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
【答案】(1)①N2+ 3H2![]() 2NH3 ②4NH3 + 5O2
2NH3 ②4NH3 + 5O2![]() 4NO + 6H2O
4NO + 6H2O
(2)①c(OH-)增大,使NH4++ OH-![]() NH3·H2O
NH3·H2O![]() NH3+ H2O平衡正向移动,利于生成氨气,被空气吹出②3.4
NH3+ H2O平衡正向移动,利于生成氨气,被空气吹出②3.4
(3)①CH3COO-- 8e-+ 2H2O ="==" 2CO2+ 7H+,②NH4+在好氧微生物反应器中转化为NO3-:NH4++ 2O2="==" NO3- + 2H++ H2O;
NO3-在MFC电池正极转化为N2:2NO3- +12H++ 10e- ="==" N2 + 6H2O (2分)
【解析】试题分析:(1)①工业合成氨是利用氮气和氢气催化剂作用下高温高压反应生成氨气,反应的化学方程式为:N2+3H2![]() 2NH3;
2NH3;
②氨气的催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)①利用平衡原理分析含氨氮水样中加入NaOH溶液的作用是c(OH-)增大,使NH4++OH-NH3H2ONH3+H2O平衡正向移动,利于生成氨气,被空气吹出;
②将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4mol,依据氮元素守恒2NH3~N2~6e-,
2NH3~N2~6e-,
2 6
n 6×10-4mol/L
n=2×10-4mol/L;水样中氨氮(以氨气计)含量=2×10-4mol/L×17g/mol=3.4×10-3g/L=3.4mg/L;
(3)①图示分析可知微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,NO3-离子在正极得到电子生成氮气发生还原反应,CH3COO-在原电池负极失电子生成二氧化碳气体,发生氧化反应,环境为酸性介质,则A极的电极反应式为:CH3COO--8e-+2H2O═2CO2+7H+,B电极反应式为:2NO3-+12H++10e-═N2+6H2O;
②NH4+在好氧微生物反应器中转化为NO3-,NH4++2O2═NO3-+2H++H2O,硝酸根离子在原电池正极发生还原反应生成氮气,2NO3-+12H++10e-═N2+6H2O。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】体积为1 mL、浓度均为0.10 mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是

A. XOH是弱碱
B. pH=10的两种溶液中的c(X+):XOH大于X2CO3
C. 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D. 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列提纯物质选用的试剂(或操作)和原理均正确的是
物质(杂质) | 试剂(或操作) | 原理 | |
A A | 乙烯(二氧化硫) | 溴水 | 二氧化硫能与溴水反应 |
B | 溴苯(溴) | 乙醇 | 溴易溶于乙醇 |
C | 正丁醇(乙醚) | 蒸馏 | 正丁醇与乙醚沸点相差较大 |
D | 乙烷(乙烯) | 酸性KMnO4溶液 | 乙烯能与酸性KMnO4溶液反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种物质:A、金刚石和石墨 B、C2H6和C5H12 C、12C和14C D、正丁烷和异戊烷 E、葡萄糖和果糖 F、红磷和白磷G、NH4CNO与尿素(CO(NH2)2) H、35Cl和37Cl I、 J、
J、
(1)属于同分异构体的是 ____________(填序号,下同);
(2)属于同素异形体的是__________(3)属于同系物的是___________
(4)属于同位素的是______________(5)属于同一种物质的是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A—I均为芳香族化合物,A的分子式为C8H10O, E的分子式为C7H7Cl,I的分子式为C23H22O3 ②A的苯环上只有一个取代基,B能发生银镜反应,D的相对分子质量比C大4,E的核磁共振氢谱有3组峰
③![]() ④
④![]()
芳香酯I的合成路线如下:

请回答下列问题:
(1)A→B的反应类型为____________,E的名称为____________;
(2) B与银氨溶液反应的化学方程式为 __________________________________________;
(3) I的结构简式为_________________________________________________;
(4)符合下列要求A的同分异构体还有______________________种(不包括A);
①与Na反应并产生H2 ②芳香族化合物
(5)根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任用)_____________。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A. 该反应中 NO2-被还原 B. 反应过程中溶液的pH 减小
C. 生成1 mol NaNO3需消耗 0.4mol KMnO4 D. □中的粒子是 OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某一在水溶液中进行的反应体系中,有反应物和生成物共六种物质,这六种物质是: HCl(浓)、KMnO4、MnCl2、H2O、Cl2、 KCl,已知Cl2、KCl 为生成物。
(1)该反应中的氧化剂是_______(写化学式),氧化产物为____ (写化学式),该反应中,氧化产物与还原产物的物质的量之比为__________
(2) 写出该反应的离子方程式:________________
(3) 用单线桥表示该反应电子转移的方向和数目。______________
(4)HCl 在上述反应中体现出米的性质是___________
(5)用该反应制得了标况下560mLCl2,则被氧化的物质为_____mol,转移电子数为______NA(NA表示阿伏伽德罗常数的值)。
Ⅱ.高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法闻接测定石灰石中CaCO3的含量的方法为: 称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4 用去浓度为0.0 16mo/LKMnO4 溶液25.00mL。
(1)写出CaC2O4沉淀溶解的离子方程式:___________________
(2)配平并完成下列高锰酸钾滴定草酸反应的离子方程式:_____________
口MnO4-+ 口H2C2O4+H+=口Mn2++口CO2↑+口
(3)①石灰石中CaCO3的百分含量:_______
②滴定反应中产生的标准状况下的CO2气体为_____mL (保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实解释正确的是( )
选项 | 现象 | 解释 |
A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
B | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO |
D | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com