
| A. | 金属钠久置于空气中,先变暗,再变白,又“出汗”,最后变成白色固体 | |
| B. | 由海水制备金属镁和游离态的溴 | |
| C. | 工业上用石灰石、石英、纯碱制玻璃 | |
| D. | 高温下用二氧化硅和碳反应制备粗硅 |
分析 发生的反应中存在元素的化合价变化,则发生氧化还原反应,以此来解答.
解答 解:A.金属钠久置于空气中,先生成氧化钠,最终生成碳酸钠,钠元素化合价发生变化,属于氧化还原反应,故A不选;
B.由海水制备金属镁和游离态的溴Mg、Br元素化合价发生变化,由化合态变为游离态,属于氧化还原反应,故B不选;
C.工业上用石灰石、石英、纯碱制玻璃,没有元素的化合价变化,不发生氧化还原反应,故C选;
D.高温下用二氧化硅和碳反应制备粗硅,C、Si元素化合价发生变化,属于氧化还原反应,故D不选.
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应的应用及化学与生活的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
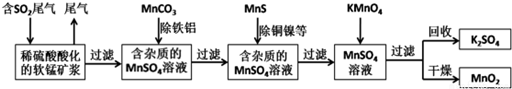
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和液化都是物理变化,向煤中加入适量CaSO4,可大大减少产物中SO2的量 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | PM 2.5、二氧化碳都属于空气质量日报的内容 | |
| D. | Na、K合金熔点低,可用作原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8g甲烷(12CH4)所含的中子数为5NA | |
| B. | 64g的铜发生氧化还原反应,一定失去2NA个电子 | |
| C. | 常温常压下,0.5 mol•L-1的乙酸溶液中,乙酸的分子数目略小于0.05NA | |
| D. | 标准状况下,22.4L 氧单质中氧原子数可能为2.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 足量二氧化碳通入NaOH溶液:CO2+OH-═HCO3- | |
| C. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al→Al2O3→Al(OH)3→AlCl3 | B. | Fe→FeCl3→Fe(OH)3→Fe2O3 | ||
| C. | Mg→MgCl2→Mg(OH)2→MgSO4 | D. | Na→NaOH→Na2CO3→NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正反应为放热反应 | |
| B. | 图中P点:v(正)>v(逆) | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.016mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若金属有剩余,在溶液中再滴入硫酸后,金属不溶解 | |
| B. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| C. | 若金属全部溶解,则溶液中一定含有Fe2+ | |
| D. | 若金属有剩余,不可能只有铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com