
【题目】已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如下表。
氢氧化物 | 溶液pH | |||
开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
Fe(OH)3 | 2.3 | 3.4 | —— | —— |
Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2溶液,形成沉淀的情况如下图所示。以下推断错误的是
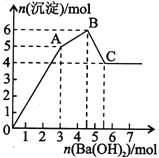
A.AB段可能发生的反应:2Ba2++3OH-+2SO42-+Al3+=2BaSO4↓+Al(OH)3↓
B.C点对应的沉淀:Fe(OH)3和BaSO4
C.OA段可能发生的反应:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓
D.据图计算原溶液中:c(Cl-)=c(SO42-)
【答案】A
【解析】
试题分析:Al2(SO4)3和 FeCl3的混合溶液与Ba(OH)2溶液反应的实质是Fe3+,Al3+与OH-、Ba2+与SO42-之间的离子反应为:Ba2++SO42-═BaSO4↓、Fe3++3OH-=Fe(OH)3↓、Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,假设1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2的物质的量为3mol,提供6molOH-,图表分析,铁离子先沉淀,由图象分析,OA段为加入3molBa(OH)2,发生反应Ba2++SO42-═BaSO4↓,得到3molBaSO4沉淀,C点为氢氧化铝溶解后的沉淀物质的量为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀3mol钡离了,1mol铁离子和1mol铝离子;AB段为沉淀1mol铝离子;BC段为溶解氢氧化铝消耗氢氧化钡1mol。A.AB段可能发生的反应是:Al3++3OH-=Al(OH)3↓,A项错误;B.根据分析可知,C点沉淀为BaSO4和Fe(OH)3,B项正确;C.OA段可能发生的反应有沉淀钡离子,铁离子,铝离子,反应为,3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓,也可能发生3Ba2++6OH-+3SO42-+2Fe3+=3BaSO4↓+2Fe(OH)3↓,C项正确;D.图象分析FeCl3、Al2(SO4)3的混和溶液中含FeCl31mol,含Al2(SO4)31mol,则c(Cl-)=c(SO42-),D项正确;答案选A。


科目:高中化学 来源: 题型:
【题目】在实验室中,下列除去杂质的方法不正确的是
A.溴苯中混有溴,加稀氢氧化钠反复洗涤、分液
B.乙烯中混有SO2、CO2,将其通入NaOH溶液洗气
C.除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠溶液的洗气瓶
D.乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有部分元素的性质与原子(或分子)结构如下表,根据信息回答下列问题:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 其气态氢化物与最高价氧化物对应的水化物能起化合反应 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
W | L层电子数是K层和M层电子数之和 |
(1)写出元素X形成的单质的电子式:__________;
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物对应的水化物的碱性比Z强
(3)元素T与元素W相比,非金属性较强的是________(用元素符号表示),写出一个能表示T、W非金属性强弱关系的化学反应方程式 。
(4)写出T与Y形成的化合物的化学式__________,__________。
(5)元素T和氢元素以原子个数比1∶1化合形成化合物P,元素X与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物Q,P与Q发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。

(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为______________微粒之间存在的作用力是_____________。
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为______。
,0)。则D原子的坐标参数为______。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为__________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日23:30左右天津滨海新区第五大街与跃进路交叉口的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品。现场火光冲天,在强烈爆炸声后,高数十米的灰白色蘑菇云瞬间腾起。爆炸造成重大的人员伤亡和财产损失。血的教训告诉我们:水火无情。下列物质(或存放仓库)着火时,可以直接用水扑灭的是 ( )
A.植物油B.电石
C.棉被、衣物D.过氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L。下列判断正确的是( )
xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L。下列判断正确的是( )
A.x =1
B.A的平均反应速率为0.3mol/(L·s)
C.B的转化率为60%
D.若混合气体的密度不再改变时,该反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶澄清溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、Mg2+、I-、NO3-、CO32-、SO42-、AlO2-。取该溶液进行以下实验:
①用PH试纸检验,溶液呈强酸性;
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色;
③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为碱性;b.溶液逐渐产生沉淀
c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
其中产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如下图所示。
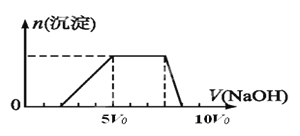
④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除 的存在。
(2)由②可以证明 的存在;同时排除 的存在;
(3)由①③可以推知该溶液中一定含有的阳离子是 ,它们的物质的量浓度比为 。
(4)由④可以证明 的存在,同时排除 的存在。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com