
【题目】有部分元素的性质与原子(或分子)结构如下表,根据信息回答下列问题:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 其气态氢化物与最高价氧化物对应的水化物能起化合反应 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
W | L层电子数是K层和M层电子数之和 |
(1)写出元素X形成的单质的电子式:__________;
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物对应的水化物的碱性比Z强
(3)元素T与元素W相比,非金属性较强的是________(用元素符号表示),写出一个能表示T、W非金属性强弱关系的化学反应方程式 。
(4)写出T与Y形成的化合物的化学式__________,__________。
(5)元素T和氢元素以原子个数比1∶1化合形成化合物P,元素X与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物Q,P与Q发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:_____________________________。
【答案】(1)![]() (2)Na;cd (3)O;2H2S+O2=2S+2H2O (4)Na2O、Na2O2
(2)Na;cd (3)O;2H2S+O2=2S+2H2O (4)Na2O、Na2O2
(5)N2H4+2H2O2=N2+4H2O
【解析】试题分析:T最外层电子数是次外层电子数的3倍,则T只能是第二周期元素,所以T是O;X的气态氢化物与最高价氧化物对应的水化物能起化合反应,因此X是N;Y的M层比K层少1个电子,则Y的族序数是11,即Y是Na;Z是第三周期元素的简单离子中半径最小,所以Z是Al;W的L层电子数是K层和M层电子数之和,则M层是8-2=6,因此W是S。
(1)氮气的电子式为![]() ;
;
(2)a.金属性强弱与单质的熔沸点没有关系,a错误;b.金属性强弱与化合价没有关系,b错误;c.钠单质与水反应比铝单质剧烈,说明金属性钠强于铝,c正确;d.金属性越强,最高价氧化物水化物的碱性越强,则Y最高价氧化物对应的水化物的碱性比Z强说明金属性钠强于铝,d正确,答案选cd。
(3)同主族自上而下非金属性逐渐减弱,则氧元素的非金属性强于硫。能表示二者非金属性强弱关系的化学反应方程式可以是2H2S+O2=2S+2H2O。
(4)O与Na形成的化合物的化学式Na2O、Na2O2。
(5)元素T和氢元素以原子个数比1∶1化合形成化合物P,P是双氧水。元素X与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物Q,则Q是N2H4,二者发生氧化还原反应,生成氮气和水,则该反应的化学方程式为N2H4+2H2O2=N2+4H2O。


科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是

A.该反应的化学方程式为3B+2D 6A+4C
B.反应进行到1 s时,v(A)=3v(D)
C.反应进行到6 s时,B的平均反应速率为0.1mol/(Ls)
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中错误的是( )
A.除去乙酸乙酯中的少量乙酸:加入饱和Na2CO3溶液,分液
B.除去Fe2O3中的少量Al2O3:加入过量NaOH溶液,过滤,洗涤干燥
C.除去氯气中的少量氯化氢:通过盛有饱和食盐水溶液的洗气瓶
D.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是一种行之有效、简单易行的科学方法。某同学用下表所示形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系。下列各组中,正确的组合是( )
选项 | 甲 | 乙、丙、丁 |
A | 纯净物 | 液氯、水玻璃、明矾 |
B | 非电解质 | 冰醋酸、SO2、乙醇 |
C | 弱电解质 | CH3COOH 、氨水、H2O |
D | 碱性氧化物 | CaO、Na2O、K2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50 mg/kg |
分装日期 | |
分装企业 |
(1)I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是:________________________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是____________________________________________。
(2)已知:I2+2S2O32-===2I-+S4O62-。
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是________________________。
②b中反应所产生的I2的物质的量是______________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)____________mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如下表。
氢氧化物 | 溶液pH | |||
开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
Fe(OH)3 | 2.3 | 3.4 | —— | —— |
Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2溶液,形成沉淀的情况如下图所示。以下推断错误的是
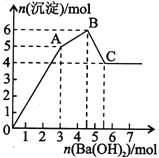
A.AB段可能发生的反应:2Ba2++3OH-+2SO42-+Al3+=2BaSO4↓+Al(OH)3↓
B.C点对应的沉淀:Fe(OH)3和BaSO4
C.OA段可能发生的反应:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓
D.据图计算原溶液中:c(Cl-)=c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提纯下列物质所选用的除杂质试剂与主要分离方法都正确的是(括号内为少量杂质),
不纯物质 | 除杂试剂 | 分离方法 | |
A | 苯(甲苯) | KMnO4(酸化),NaOH溶液 | 分液 |
B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
C | 乙酸乙酯(乙酸) | KOH溶液 | 分液 |
D | 苯(苯酚) | 浓Br2水 | 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
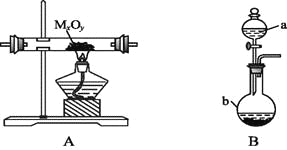
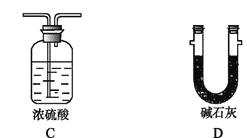
(1)仪器a的名称为 ,仪器b中装入的试剂可以是 。
(2)按气流方向正确的装置连接顺序为(填序号,装置可重复使用): 。
(3)装置C的作用: 。
(4)实验结束时,应首先 (填序号); 这样做的原因是 。
Ⅰ.熄灭A装置的酒精灯 Ⅱ.停止从a中滴加液体
(5)若金属氧化物为CuO,反应的化学方程式为 。
(6)若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,则M的相对原子质量为 (用含x、y、m、n的式子表示)。
(7)某同学仔细分析上述装置后认为仍存在缺陷,你认为该如何改进? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com