
【题目】氮、硫、氯及其化合物是中学化学重要的组成部分。
(1)氨气燃料电池使用的电解质溶液是KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为____;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____。
a.电能全部转化为化学能
b.SO42﹣的物质的量浓度不变(不考虑溶液体积变化)
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA个
(2)①将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:所得悬浊液![]() 白色沉淀
白色沉淀![]() 观察现象并判断,则试剂A的化学式为_____。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是____。
观察现象并判断,则试剂A的化学式为_____。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是____。
②利用如图所示电化学装置吸收工业尾气中SO2,阴极上生成Cu。写出装置中阳极的电极反应式_____。

【答案】2NH3+6OH--6e-=N2+6H2O bd HCl 2SO2+2Ba2++O2+2H2O=2BaSO4↓+4H+ SO2+2H2O-2e-=4H++SO42-
【解析】
(1)依据化学方程式分析化合价变化,判断发生氧化反应的物质是氨气,原电池中氨气在负极失电子,正极上氧气得到电子生成氢氧根离子;电解精炼铜时利用了电解原理,电能转化为化学能,也有少量转化为热能;电解精炼时粗铜做阳极,发生氧化反应,精铜做阴极,阴极上发生还原反应;电解时,溶液中的阳离子向阴极移动,在阴极上得电子;粗铜中的不活泼金属不能失电子,以阳极泥的形式沉积在阳极附近;
(2)①实现固体和液体的分离可以采用过滤的方法;硫酸钡和盐酸不反应,但是亚硫酸钡可以和盐酸反应;加入试剂A后,白色沉淀未见溶解,可知沉淀是硫酸钡;
②电解池中吸收工业尾气中SO2,阳极是二氧化硫失电子发生氧化反应生成硫酸根离子;
(1)根据总反应4NH3+3O2=2N2+6H2O,负极是氨气失电子生成氮气和水,负极反应式是2NH3+6OH--6e-=N2+6H2O;
电解精炼铜时利用了电解原理,a、电能转化为化学能,也有少量转化为热能,故a错误;
b、电解精炼时粗铜做阳极,发生氧化反应,阳极是铜、铝、锌失电子发生氧化反应,精铜做阴极,溶液中铜离子在阴极得到电子发生还原反应,溶液中SO42﹣不参加反应,SO42﹣浓度不变,故b正确;
c、电解时,溶液中的阳离子向阴极移动,在阴极上得电子,溶液中Cu2+向阴极移动,故c错误;
d、粗铜中的不活泼金属Ag、Pt、Au不能失电子,以阳极泥的形式沉积在阳极附近,利用阳极泥可回收Ag、Pt、Au等金属,故d正确;
e.若阳极质量减少64g,铜、铝、锌都失电子发生氧化反应,电子转移不是2mol,故e错误;
(2)①实现固体和液体的分离可以采用过滤的方法,将SO2通入到BaCl2溶液中,出现的白色浑浊可能是硫酸钡也可能是亚硫酸钡,硫酸钡和盐酸不反应,但是亚硫酸钡可以和盐酸反应,并溶解,可以用盐酸来鉴别沉淀成分,所以试剂A是HCl;实验表明,加入试剂HCl后,白色沉淀未见溶解,说明沉淀是硫酸钡,产生硫酸钡沉淀的离子方程式是2SO2+2Ba2++O2+2H2O═2BaSO4↓+4H+;
②电解池中吸收工业尾气中SO2,阳极是二氧化硫失电子发生氧化反应生成硫酸根离子,电极反应为:SO2+2H2O-2e-=4H++SO42-。


科目:高中化学 来源: 题型:
【题目】磷酸氯喹治疗新冠肺炎具有一定疗效。磷酸氯喹由氯喹与磷酸制备,下面是由间氯苯胺合成氯喹的一种合成路线:
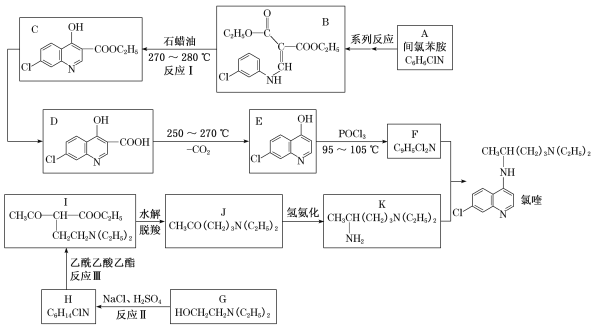
回答下列问题:
(1)已知反应I是B→C+X,推测X的名称是______,D中含氧官能团的名称是____。
(2)F的结构简式为_______________,反应II的反应类型是___________。
(3)反应III的化学方程式为____________。
(4)化合物M(C7H8ClN)是A的同系物,其某些同分异构体的核磁共振氢谱有4组峰,峰面积比为1:1:1:1,符合该要求的同分异构体有_________种。
(5)设计由氯化芐(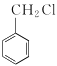 )和乙酰乙酸乙酯为原料制备
)和乙酰乙酸乙酯为原料制备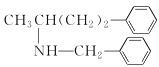 的合成路线(无机试剂任选)________。
的合成路线(无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。

A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三元电池成为2019年我国电动汽车的新能源,其电极材料可表示为![]() +3
+3![]() ,且x+y+z=1。充电时电池总反应为LiNixCoyMnzO2+6C(石墨)===Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
,且x+y+z=1。充电时电池总反应为LiNixCoyMnzO2+6C(石墨)===Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是
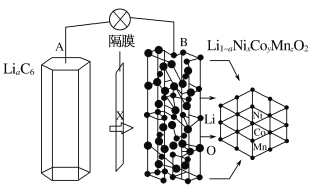
A.允许离子X通过的隔膜属于阴离子交换膜
B.充电时,A为阴极,Li+被氧化
C.可从无法充电的废旧电池的石墨电极中回收金属锂
D.放电时,正极反应式为Li1-aNixCoyMnzO2+aLi++ae-===LiNixCoyMnzO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源在人类生活中应用广泛。回答下列问题:
(1)氢气燃烧时放出大量的热,这是由于反应物的总能量____生成物的总能量(选填“大于”“小于”或“等于”,下同),从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量_____形成产物的化学键释放的总能量。
(2)H2被认为是21世纪矿物燃料的理想能源,每克氢气和汽油燃烧放出的热量分别为55kJ和46kJ。汽油可由石油经___和____获得;请分析氢气作为能源替代汽油的优势:_____;____(写两点)。
(3)在氢氧碱性燃料电池中,负极发生反应的电极反应式:___,正极的电极反应式为____。若反应后得到5.4g液态水,此时氢氧燃料电池转移的电子数为____。
(4)如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地往烧杯中央滴入CuSO4溶液。

片刻后可观察到的现象是(指悬吊的金属圈)____。
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(5)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
①写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_____。
②若将①中的反应设计成原电池,写出负极的电极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图:
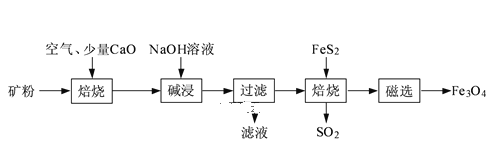
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为____。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题图所示。
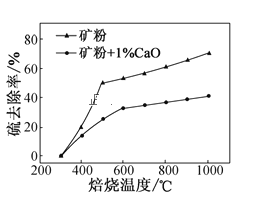
已知:多数金属硫酸盐的分解温度都高于600℃
硫去除率=(1![]() )×100%
)×100%
①不添加CaO的矿粉在低于500℃焙烧时,去除的硫元素主要来源于____。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是___。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由___(填化学式)转化为____(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与Al混合在高温下发生的反应方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向20.00mL0.10mol/L一元弱碱MOH溶液中滴0.10mol/LHCl溶液,混合溶液的pH、pOH变化曲线如图所示。已知pOH=-lgc(OH-)。下列说法错误的是( )
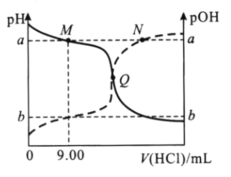
A.a+b=14
B.Q点消耗盐酸的体积小于20.00mL
C.M点和N点溶液中,![]() 相等
相等
D.当V(HCl)=10.00mL时,c(M+)-c(MOH)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚主要用于替代汽车燃油、制氢及用于燃料电池原料。 回答下列问题
⑴二甲醚在加热条件下能发生分解:(CH3)2O(g)→CH4(g)+H2(g)+CO(g),在某温度压强下测定其动力学数据如下:
t/s | 0 | 200 | 400 | 600 | 800 |
c[(CH3)2O]/mol·L-1 | 0.01000 | 0.00916 | 0.00839 | 0.00768 | 0.00702 |
0~800s 的二甲醚平均反应速率为__________________ 。
⑵一种“直接二甲醚燃料电池”结构如下图所示,电解质为强酸溶液。电池工作时,能量转化方式为______,负极的电极反应式为 ____。

⑶二甲醚与水蒸气重整制 H2,相同投料比及流速时,单位时间内 H2 产率与催化剂及温度下关系如下图 所示,适宜的催化剂是______(选填 a、b、c)及适宜的温度是____ 。
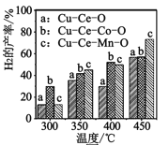
⑷工业中用 CO 和 H2 为原料可制取二甲醚,在 250℃、5MPa 及催化剂作用下,在反应器中合成。
a:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) K1
b:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) K2
c:CO(g)+2H2(g) CH3OH(g)
已知:投料比 n(H2)/n(CO2)与原料气转化率的关系如下图 所示。
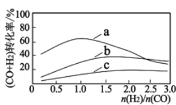
①最佳 n(H2)/n(CO)比为_________________ (填图中数字)。
②同一温度下,CO(g)+H2O(g) CO2(g)+H2(g)平衡常数为 K3,则 K3=__________用含 K1、K2 代数式表示)。
⑸已知反应 CO2(g)+3H2(g) CH3OH(g)+H2O(g)。一定条件下,向体积为 1L 的密闭容器中充入 1molCO2和 3molH2,测得 3min 时υ(H2)=0.5mol/L·min,10min 时达到平衡,平衡时,CO2 转化率为 75%,在下图中 画出 CO2 和 CH3OH(g)的浓度随时间变化曲线________。
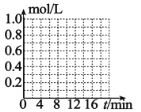
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com