
【题目】室温下两种金属硫化物MS、QS的沉淀溶解平衡曲线分别为图中的I、II (X2+代表 M2+或Q2+),下列有关说法中正确的是
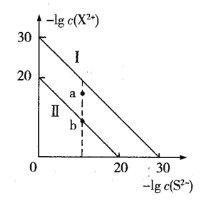
A.MS易与可溶性Q(N03)2的溶液作用转化为QS
B.与a点对应的由MS形成的分散系很稳定
C.向c(M2+)>c(Q2+)的混合溶液中滴加Na2S溶液,首先析出MS沉淀
D.蒸发a点的QS溶液可得到b点状态的QS溶液
【答案】C
【解析】
A、由图知,当-lgc(S2-)=0、c(S2-)=1mol/L时,c(M2+)=1![]() 10-30 mol/L、 c(Q2+)=1
10-30 mol/L、 c(Q2+)=1![]() 10-20mol/L,故 Ksp(MS)=1
10-20mol/L,故 Ksp(MS)=1![]() 10-30,Ksp(QS)=1
10-30,Ksp(QS)=1![]() 10-20,MS(s)+Q2+(aq)
10-20,MS(s)+Q2+(aq) ![]() QS(s)+M2+(aq), K=
QS(s)+M2+(aq), K=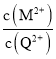 =1
=1![]() 10-10,K值很小,故该转化很难进行,选项A错误;
10-10,K值很小,故该转化很难进行,选项A错误;
B、a 点对应的分散系相对于MS而言属于过饱和溶液,不稳定,选项B错误;
C、由于MS、QS组成形式相同且Ksp(QS)> Ksp(MS), (故相同条件下MS先形成沉淀,选项C正确;
D、蒸发QS的不饱和溶液时,c(Q2+)、c(S2- )均增大,选项D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。
![]()
已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
Ⅱ.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是______________。
(2)吸收塔中的原料B可以选用_____________(填字母序号)。
A.NaCl溶液 B.Na2CO3溶液 C.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3的过程(加热装置已略去)。
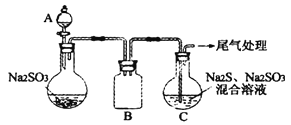
①A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是_____________。装置B的作用是______________。
②C中制备Na2S2O3发生的连续反应有:Na2S+H2O+SO2=Na2SO3+H2S_____________和Na2SO3+S![]() Na2S2O3 。
Na2S2O3 。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应 X2(g)+Y2(g) ![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能为
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能为
A. Y2为0.4mol/LB. Z为0.3mol/L
C. X2为0.2mol/LD. Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答问题:
(1)Deacon发明的直接氧化法为:4HCl(g) + O2(g) ![]() 2Cl2(g) +2H2O(g)。如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:可知反应平衡常数K(300℃)_________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比的数据计算c(HCl):c(O2) = 1:1的数据计算K(400℃)=________________(列出计算式即可)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2) 过低、过高的不利影响分别___________________________、____________________________。
2Cl2(g) +2H2O(g)。如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:可知反应平衡常数K(300℃)_________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比的数据计算c(HCl):c(O2) = 1:1的数据计算K(400℃)=________________(列出计算式即可)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2) 过低、过高的不利影响分别___________________________、____________________________。
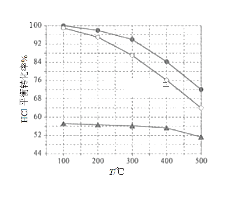
(2)在一定温度的条件下,进一步提高HCl的转化率的方法是__________________________、___________________________________。(写出2种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为![]() 。下列比较中正确的是( )
。下列比较中正确的是( )
A. 原子半径:a>c>d>b B. 电负性a>b>d>c
C. 原子序数:d>a>c>b D. 最高价含氧酸的酸性c>d>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用图示装置制备高铁酸钾(K2FeO4)并探究其性质。已知:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。制取实验完成后,取C中紫色溶液,加入稀盐酸,产生气体。下列说法不正确的是

A.B瓶应盛放饱和食盐水除去混有的HCl
B.C瓶中KOH过量更有利于高铁酸钾的生成
C.加盐酸产生气体可说明氧化性:K2FeO4>Cl2
D.高铁酸钾是集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等八大特点为一体的优良的水处理剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿黑酸是由酪氨酸在人体内非正常代谢而产生的一种物质。其转化过程如下:

下列说法错误的是( )
A.对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个
B.1mol尿黑酸与足量NaHCO3反应,最多消耗3molNaHCO3
C.酪氨酸既能与盐酸反应,又能与氢氧化钠反应
D.1mol尿黑酸与足量浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。
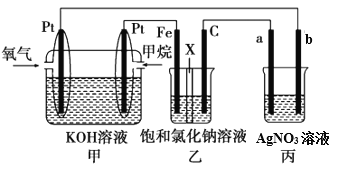
请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:____________________________________。
(2)向乙中加入几滴酚酞溶液,工作一段时间后铁电极附近溶液变红,请用化学用语解释相关原因__________________________________
(3)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成的气体的物质的量为__________。
(4)欲用丙装置给铜镀银,b应是____________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com