
��80��ʱ����0��8mol��A�������4L�ѳ�յĹ̶��ݻ����ܱ������з�����Ӧ��A(g)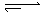 mB(g)��һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
mB(g)��һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
|
ʱ�䣨s�� c��mol/L�� |
0 |
20 |
40 |
60 |
80 |
100 |
|
c��A�� |
0��20 |
0��14 |
b |
0.09 |
0.09 |
0.09 |
|
c��B�� |
0��00 |
0��12 |
0.20 |
c |
d |
e |
��1��m= ������b c���<������=����>������
��2��100������������������С��ԭ��һ�룬ƽ��ʱA��Ũ��____________0.09 mol/L���<������=����>������
��3����80��ʱ�÷�Ӧ��ƽ�ⳣ��KֵΪ ������1λС������
��4��������������ͬʱ���÷�Ӧ��KֵԽ��������ƽ��ʱ ��
��A��ת����Խ�� ��A��B��Ũ��֮��Խ��
��B�IJ���Խ�� ������Ӧ���еij̶�Խ��
��8�֣���1��2��< ��2��> ��3��0.5�� ��4���٢ڢ�
��������
�����������1�����ݱ������ݿ�֪����Ӧ���е�20sʱ��A��Ũ�ȼ�����0.20mol/L��0.14mol��0.06mol/L��B��Ũ��������0.12mol/L������Ũ�ȵı仯��֮������Ӧ�Ļ�ѧ������֮�ȿ�֪��m��2�����ݷ���ʽ��֪����b��0.09����2��c��0.20�����2b��c��0.02������b��c��
��2���÷�Ӧ���������Ŀ��淴Ӧ����������ѹǿ��ƽ�����淴Ӧ�����ƶ�����100������������������С��ԭ��һ�룬ƽ��ʱA��Ũ�ȣ�0.09 mol/L��
��3�����ݱ������ݿ�֪��ƽ��ʱA��Ũ����0.09mol/L����ƽ��ʱB��Ũ���ǣ�0.2mol/L��0.09mol/L����2��0.22mol/L��������80��ʱ�÷�Ӧ��ƽ�ⳣ��KֵΪ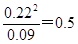 ��
��
��4����ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ������������������ͬʱ���÷�Ӧ��KֵԽ����A��ת����Խ�ߣ�A��B��Ũ��֮��Խ������Ӧ���еij̶�Խ��B�IJ�����һ��Խ��ѡ�٢ڢܡ�
���㣺������淴Ӧ���йؼ��㡢ƽ�ⳣ���ļ����Ӧ���Լ����������ƽ��״̬��Ӱ��
�����������Ǹ߿��еij������ͣ������е��Ѷȵ����⡣�����ۺ���ǿ�����ض�ѧ�������������ͽ��ⷽ����ָ����ѵ����ּ������ѧ��������û���֪ʶ���ʵ�����������������������ѧ���������������ͷ�ɢ˼ά����������������ѧ����ѧ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?����ģ�⣩80��ʱ����0.40mol��N2O4�������2L�Ѿ���յĹ̶��ݻ����ܱ������У��������·�Ӧ��N2O4?2NO2����H��0��һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
��2012?����ģ�⣩80��ʱ����0.40mol��N2O4�������2L�Ѿ���յĹ̶��ݻ����ܱ������У��������·�Ӧ��N2O4?2NO2����H��0��һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�| ʱ�䣨s��n��mol�� | 0 | 20 | 40 | 60 | 80 | 100 |
| n��N2O4�� | 0.40 | a | 0.20 | c | d | e |
| n��NO2�� | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʱ��/s c/mol?L-1 |
0 | 20 | 40 | 60 | 80 | 100 |
| N2O4 | 0.20 | a | 0.10 | c | d | e |
| NO2 | 0 | 0.12 | b | 0.26 | 0.30 | 0.30 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��100��ʱ����0.4mol�Ķ��������������2L����յ��ܱ������У�ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ����±����ݣ�
��100��ʱ����0.4mol�Ķ��������������2L����յ��ܱ������У�ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ����±����ݣ�| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| n��NO2��/mol | 0.4 | n1 | 0.26 | n3 | n4 |
| n��N2O4��/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
 N2O4��ƽ�ⳣ����
N2O4��ƽ�ⳣ���� N2O4��
N2O4���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��100��ʱ����0.40mol���������������2L��յ��ܱ������У�ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ����±����ݣ�
��100��ʱ����0.40mol���������������2L��յ��ܱ������У�ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ����±����ݣ�| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| n��NO2��/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��������ѧ֪ʶ������������⣺
��������ѧ֪ʶ������������⣺ H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��| �¶�/��C | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
| ʱ��/s | 0 | 20 | 40 | 60 | 80 |
| n��NO2��/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com